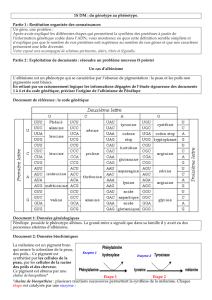
Partie 2 : Exploitation de documents : résoudre un problème... Un cas d’albinisme

Partie 2 : Exploitation de documents : résoudre un problème nouveau (5 points)
Un cas d’albinisme
L’albinisme est un phénotype qui se caractérise par l’absence de pigmentation : la peau et les poils non
pigmentés sont blancs.
En reliant par un raisonnement logique les informations dégagées de l’étude rigoureuse des documents
1 à 4 et du code génétique, préciser l’origine de l’albinisme de Pénélope
Document de référence : le code génétique
Pb : On se demande quelle est l’origine de l’albinisme (absence de pigmentation) de Pénélope
Document 1: Données généalogiques
Pénélope possède le phénotype albinos. La grand-mère a signalé que dans sa famille il y avait eu des
personnes atteintes d’albinisme.
La présence d’autres personnes atteintes dans la famille suggère qu’il s’agit d’une maladie héréditaire,
génétique.
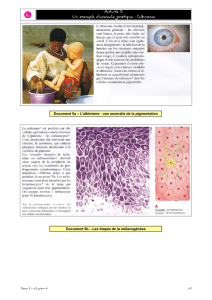
Document 2 : Données biochimiques
La mélanine est un pigment brun
qui assure la coloration de la peau,
des poils... Ce pigment est
synthétisé par les cellules de la
peau, par les cellules de la racine
des poils et des cheveux.
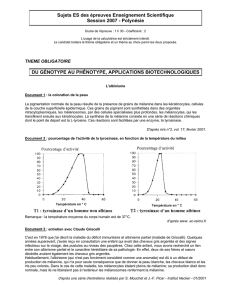
Ce pigment est obtenu par une
chaîne de biosynthèse*
Etape 1 Etape 2
*chaîne de biosynthèse : plusieurs réactions successives permettent la synthèse de la mélanine. Chaque
étape est catalysée par une enzyme :
- Etape 1 : action de la phénylalanine hydroxylase
- Etape 2 : action de la tyrosinase
La tyrosinase et la phénylalanine hydroxylase sont des enzymes donc des protéines qui catalysent
(accélèrent) les réactions chimiques.
La phénylalanine (Acide Aminé) est fournie par l’alimentation.
Enzyme'1'
Enzyme'2'

L’albinisme est souvent lié à une autre maladie héréditaire, la phénylcétonurie. Celle‐ci se manifeste
lorsque la phénylalanine n’est plus transformée en tyrosine : la phénylalanine en excès est transformée en
acide phénylpyruvique toxique, dont la présence est décelée dans le sang et les urines.
L’absence de pigmentation semble liée à une absence de synthèse de mélanine (pigment) dans les cellules
de la peau ou de la racine des poils et des cheveux.
On peut imaginer que ce sont les enzymes impliquées dans la chaîne de biosynthèse de la mélanine qui ne
fonctionnent pas.
- si l’enzyme 1 ne fonctionne pas il n’y aura pas de tyrosine et donc pas de mélanine, donc albinisme
et phénylcétonurie.
- Si l’enzyme 2 ne fonctionne pas la tyrosine ne sera pas transformée en mélanine et la personne sera
albinos
Document 3: Données cliniques.
Analyse d’urine : aucune trace d’acide phénylpyruvique
Analyse de cheveux : les racines intactes des cheveux de Pénélope sont plongées dans une solution
contenant de la tyrosine : les cellules de Pénélope restent blanches
L’absence d’acide phénylpyruvique indique que l’enzyme 1 fonctionne chez Pénélope.
Mais l’absence de pigmentation en présence de tyrosine montre que c’est l’enzyme 2 qui semble non
fonctionnelle.
Document 4: Données moléculaires.
Le gène de la tyrosinase de Pénélope a été séquencé Les deux séquences ont une longueur de 1590 bases.
Une portion de la séquence de ce gène chez Pénélope est comparée avec la séquence de ce gène chez une
personne non albinos (brin transcrit)
Pénélope((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((((
On observe une mutation : en position 533 le nucléotide C est remplacé par T.
Transcription du brin codant :
GGA UCA ACA CCC AUG UUU AAC GAC AUC AAU AUU UAU GAC CUC UUU GUC UGG AUG CAU UAU UAU GUG UCA AUG GAU GCA CUG CUU GGG GGA
A
!
Traduction en utilisant le code génétique :
Cette mutation entraîne l’apparition anticipée d’un codon STOP (mutation « non sens »), la synthèse de la
protéine est interrompue, elle ne comporte 176 acide aminés.
Or nous savons qu’une protéine est caractérisée par sa séquence qui détermine sa forme et sa fonction. Si la
protéine est écourtée, elle n’est pas fonctionnelle, ne remplit pas sa fonction
Mise en relation :
L’albinisme de Pénélope est dû à une mutation du gène de la tyrosinase, une substitution au niveau du
179°codon (C!T) provoque l’apparition anticipée d’un codon STOP (UAG) qui interrompt la synthèse de
la tyrosinase. (Doc. 4)
L’enzyme écourtée n’est plus fonctionnelle et la tyrosine n’est pas transformée en mélanine dans les
cellules de la peau, des racines des poils et des cheveux (Doc.2) d’où l’absence de pigmentation et le
phénotype « albinos » de Pénélope.
Les analyses de Pénélope montrent que seule la tyrosinase dysfonctionne, l’enzyme 1 de la chaîne de
biosynthèse est normale (Doc. 2) puisqu’on ne note pas la présence d’acide phénylpyruvique dans les
urines, donc la phénylalanine est correctement transformée en tyrosine. (Doc. 3)
Il s’agit donc d’une maladie héréditaire ce qui est vérifié par la généalogie de Pénélope (Doc.1)

Document 5 : Allons plus loin :
Exercice 1 : analyse génétique de l’arbre généalogique de Pénélope (II7)
Le frère de pénélope (II5) attend un nouvel enfant, or le frère de sa femme (II3) est albinos, il s’inquiète. Elle
vient vous voir pour évaluer les risques courus par l ‘enfant à naître.
Réalisez une analyse génétique de cette famille :
- Etablissez les
rapports de dominance
entre les allèles, on notera
avec une majuscule l’allèle
dominant et une minuscule
l’allèle récessif
- Etablissez les
génotypes des membres
de la famille
- Donnez les
probabilités de génotype
pour l’enfant à naître.
Rapport de dominance :
II3 et II7 sont albinos alors que leurs parents ne le sont pas, or ils possédaient l’allèle anormal qu’ils ont
transmis à leurs enfants mais ne l’expriment pas : l’allèle est récessif.
Allèle normal : T (pour tyrosinase) allèle muté : t
T>t
Etablissement des génotypes :
On part de la génération III et de ce dont on est certain :
- phénotype normal : au moins un allèle normal T
- phénotype albinos : allèle récessif donc génotype homozygote (t//t) : II3 et II7
La génération I est obligatoirement hétérozygote (T//t) puisqu’ils ont un enfant albinos
II1, 2, 4, 5, 6 ; III1 et 3 sont hétérozygotes (T//t) ou homozygote (T//T)
Spermatozoïdes
I1, 3
I2, 4
T /
t/
ovocytes
T/
T//T
[T]
T//t
[T]
t/
T//t
[T]
t//t
[t]
L’enfant à naître
II2 et 5 sont (T//T) ou (T//t)
- Si les 2 sont (T//T) l’enfant à naître à 100% de chance d’être [T] : (T//T)
- Si un des 2 est hétérozygote l’enfant à naître a 100% de chance d’être [T] mais ½ chance d’être
(T//t) et ½ d’être (T//T)
- Si les 2 sont hétérozygotes l’enfant a ¼ d’être albinos [t] (t//t) et ¾ d’être normal [T]
Cependant, des analyses ont été pratiquées sur II3 :
Les dosages sanguins montrent un taux élevé d’acide phénylpyruvique
Un test a été pratiqué sur les racines des cheveux de II3 : plongées dans de la tyrosine elles produisent de la
mélanine.
t//t!
?!
T//t!
Ou!!
T//T!
T//t(
T//t(
T//t(
T//t(
t//t!
T//t!
Ou!!
T//T!
T//t!
Ou!!
T//T!
T//t!
Ou!!
T//T!
T//t!
Ou!!
T//T!
T//t!
Ou!!
T//T!
T//t!
Ou!!
T//T!
T//t!
Ou!!
T//T!

La présence d’un taux élevé d’acide phénylpyruvique dans les urines de II3 montre que son albinisme est
lié à un dysfonctionnement de l’enzyme 1 de la chaîne de biosynthèse (Doc. 2) : la phénylalanine ne se
transforme pas en tyrosine.
Par contre les racines des cheveux plongées dans de la tyrosine permet la synthèse de mélanine, donc
l’enzyme 2 (tyrosinase) fonctionne.
2 gènes sont donc impliqués E1 et E1, chacun existant sous 2 formes allèliques :
- E1 : PH (normal) et ph (muté)
- E2 : T (normal) et T(muté)
Donc le génotype d’une personne albinos peut être :
(ph//ph ; T//T), (ph//ph ; T//t), (PH//PH ; t//t), (PH//ph ; t//t), (ph//ph ; t//t)
E1 non fonctionnelle , E 2 non fonctionnelle , E1 et E2 non fonctionnelles
Cas de II 3
Comme on ne connaît pas la forme d’albinisme de la famille de II7, on ne peut réaliser de calculs sérieux
mais on comprend que les possibilités augmentent…
1
/
4
100%