p2-ue5-le-bail-anapath-cardiovasc-1-07-09-16-pdf

UE5- Anatomie cardiaque
Le Bail
Date : 07/09/2016 Plage horaire : 10h45-12h45
Promo : 2016-2017 Enseignant : LE BAIL
Ronéistes : Céline ROBERT/Kim MAUVISSEAU
Anatomo-pathologie cardiovasculaire 1
I. Congestion active et passive
II. Hémorragie
III. Etat de choc
IV. Athérome et athéromatose
V. Thrombose
VI. Emboles
VII. Artérites, maladie de Horton
VIII. Illustrations pratiques : lames virtuelles
Seront vues au 2e cours.

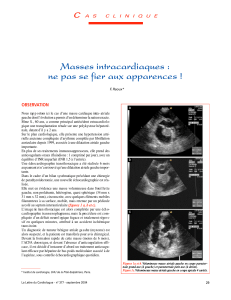
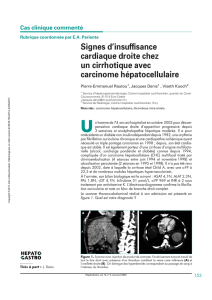
Dans ce cours, les principales maladies de l'appareil cardio-vasculaire vont être illustrées du point de vue
anatomo-pathologique.
Dans le programme de l'ENC, vous avez des références en cardio-vasculaire concernant l'anatomo-
pathologie. Les objectifs sont de:
Connaître les mécanismes physiopathologiques des troubles hémodynamiques et de la maladie
thrombo-embolique.
Définir les notions d’ischémie, d’infarctus blanc et rouge, et décrire les principales modifications
macroscopiques et microscopiques associées. Connaître et expliquer l’évolution possible de ces
lésions.
Définir l’athérosclérose, en connaître les facteurs de risque et les principales formes topographiques.
Connaître la structure générale d’une plaque athéroscléreuse et ses complications évolutives.
De plus, vous avez ce cours sur internet sur le site «Campus d'Anatomie Pathologique», rédigé par tous les
enseignants français d'anatomie-pathologie. Ce cours est donc commun au niveau national, en lien avec
l'Université Médicale Virtuelle Francophone. Pour y accéder, allez sur «Campus d'Anatomie-Pathologique»,
puis dans «1er cycle», «Chapitre 4», puis l'onglet «Cours» (http://campus.cerimes.fr/anatomie-
pathologique/enseignement/anapath_4/site/html/1.html).
L'équivalent existe aussi dans un petit livre publié par Elsevier (20 euros).
Dans ce cours, il faudra connaître certains détails macroscopiques mais aussi microscopiques.
Concernant le plan, certains rappels histologiques et anatomiques seront fait, puis nous étudierons certaines
pathologies.
Les pathologies (étudiées dans ce cours) sont découpées artificiellement dans le plan, mais peuvent être liées:
par exemple une thrombose peut entraîner une embole, c'est une de ses grandes complications; on parle de
maladie thrombo-embolique.

Rappel: Le système vasculaire sanguin
Le cœur est une pompe contenant, lorsqu'on le schématise, 2 secteurs: le secteur artériel et le secteur veineux.
Ces secteurs se répartissent dans l'organisme avec des points clés que sont les poumons, le cœur et en
périphérie le système capillaires que l'on retrouvent en position terminale dans les tissus, les organes ou au
niveau cutané.
Si on détaille bien le secteur veineux, on remarque que c'est le secteur le plus important (ici en bleu). Il
contient environ 70% du volume sanguin total. C'est un système dit capacitif, c'est-à-dire qu'il contient de
façon assez passive le sang. Et il s'y trouve un sang peu oxygéné, l'oxygène ayant été capté par les tissus.
A l'inverse, le système artériel (contenant le sang oxygéné au niveau du poumon) ne représente qu'à peu près
que 10% du volume sanguin total. C'est un système qui est résistif.
Cela est dû à la paroi musculaire, à la tonicité et aux contractions possibles des vaisseaux.
C'est au sein de ce système qu'on peut avoir des problème de pression artérielle, d'hypertension.
Le réseau capillaire représente à peu près 5% du volume sanguin total et c'est à ce niveau que se font les
échanges d'oxygène avec les cellules et les tissus.
Le sang alors pauvre en oxygène va passer par le cœur puis être ré-oxygéné grâce aux échanges faits au
niveau du poumon.
Les 15% restants du volume sanguin total se répartissent dans le système central (à savoir le cœur et les
poumons).

On voit que histologiquement, la structure des vaisseaux est différente, ceci étant en rapport avec leur
fonction.
En gros, les artères ont une paroi plus épaisse et plus tonique. On a une couche de muscle (en rouge sur ce
schéma) beaucoup plus importante.
A l'inverse, les veines (qui sont plus grosses que les artères avec lesquelles elles cheminent par chemins
associés) ont une forme beaucoup plus flasque, une paroi plus mince et une couche musculaire qui est moins
bien organisée.
Les capillaires ont une paroi très très fine, une lumière très étroite et n'ont pas de paroi musculaire.
Il y a donc la taille, la forme et la musculature des vaisseaux qui changent, mais également la quantité de
fibres musculaires lisses et la quantité de fibres élastiques.
Dans une artère (surtout les grosses artères), on a beaucoup de fibres élastiques, qui contribuent à la
contractilité et à l'adaptation du système artériel.
Sur une vue moins schématique, en 2D, de l’intérieur vers l’extérieur, on a :
L’intima, la couche interne. Elle est bordée par un endothélium très fin, à peine visible en
microscopie optique.
Tout autour, la média composée de fibres élastiques (en nombre variable selon la taille de l'artère.
Elles peuvent dessiner une limitante élastique si elles sont bien organisées) et des cellules
musculaires lisses qui peuvent ajuster le calibre de l'artère (ces cellules se mettent concentriquement
autour de la lumière) avec des fibres musculaires lisses.
Enfin l'adventice composée de collagène et des vaisseaux propres de l'artère.

I. Congestion active et passive (ou stase)
Définition : La congestion sanguine correspond à une augmentation de volume d’un tissu ou d’un organe
qui se remplit de sang. Cela se traduit au niveau macroscopique par une augmentation de poids et de
volume des tissus avec une teinte rougeâtre ou bleuâtre des tissus (en fonction du type de sang plus ou
moins artérialisé).
Il y a 2 mécanismes de congestions sanguine :
Augmentation de l’afflux de sang artériel dans le tissu (où il est stocké) : il s'agit alors d'une
congestion active. Le sang artériel étant rouge et oxygéné, les organes auront tendance à être rouge :
on parlera d'organe érythémateux (au niveau de la peau on parlera d'un érythème cutané).
La racine grecque -ery (comme érythrocyte) = rouge.
Baisse du retour veineux (le sang n’est pas drainé par le réseau veineux, il stagne): c’est la
congestion passive, on parle de stase. Le sang veineux (pauvre en O2) étant plus bleu, plus foncé, les
organes auront tendance à être bleu: on parlera d'organe cyanosé.
-cya = bleu
Comme on peut le voir sur le schéma au niveau de la boucle capillaire :
- Lors de la congestion active, le sang artériel afflue en trop grande
quantité pour être évacué par le drainage de la veinule. Cet excès de
sang va faire gonfler les tissus au niveau des capillaires et des
artérioles pré-capillaires.
Ce genre de situation peut être vu quand l'apport sanguin est
augmenté, comme au cours de l’exercice physique (au niveau des
muscles) ou le plus souvent, lors d’un processus inflammatoire.
En effet, il y a des médiateurs qui vont venir accroître le débit
artériel : une inflammation aiguë (ex: angine avec l'amygdale rouge)
va donc très souvent d'accompagner d'une congestion active et
d'érythème.
- A l’inverse pour la congestion passive, le sang arrive normalement
par l’artère, mais ici il y a un problème pour l'évacuer. C'est donc ce
sang qui a perdu son oxygène qui va s'accumuler, et l'organe va être
cyanosé.
Ce problème d'évacuation peut s'expliquer par un obstacle
mécanique au niveau de cette veine (par exemple si pour des varices
au niveau des membres inférieurs, vous avez des valves qui sont
défaillantes, le sang va être stocké. Vous aurez quelque part dans les
tissus drainés ce mécanisme de cyanose et d'hypoxie). Il peut aussi
s'expliquer par un problème au niveau du pompage général du sang,
c'est-à-dire que le cœur ponctionne mal.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
1
/
36
100%