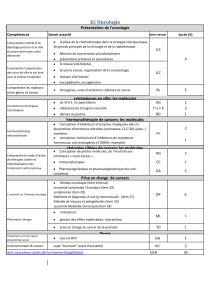
UE8 – De l’agent infectieux à l’hôte

1
UE8 – De l’agent infectieux à l’hôte
Date : 20/04/2016 Plage horaire : 10h45-12h45
Promo : 2015-2016 Enseignant : Dr POUBEAU
Ronéistes :
Philomène
GESLIN
Alexandra WAZ
Traitement Antirétroviraux (ARV)
Généralités sur les antirétroviraux
1. Historique
2. Objectif du traitement et recommandations
3. Molécules disponibles
I. Inhibiteurs de protéase (IP)
1. Molécules
2. Avantages et désavantages
II. Inhibiteurs de l’entrée
1. Entrée du VIH
2. Inhibiteur de fusion
3. Inhibiteur du récepteur CCR5
III. Inhibiteurs de l’intégrase
IV. Les complications associées aux traitements antirétroviraux

2
I. Généralités sur les antirétroviraux
Rappels :
Le virus avec ses spicules fusionne et entre dans la cellule grâce aux récepteurs et corécepteurs (CX4 et
CCR5). L’ARN du VIH se transforme en ADN sous l’action de la reverse transcriptase : cet ADN viral
s’intègre dans le matériel génétique de la cellule (souvent un Ly CD4). Il y a ensuite formation d’ARNm et
de protéines virales qui peuvent s’assembler grâce à l’action de la protéase. Bourgeonnement et maturation,
puis une nouvelle particule virale va pouvoir contaminer d’autres cellules qui portent le récepteur CD4.
C’est le cycle particulier du VIH mais assez communs avec tous les virus.
Pas détaillé : Ce qu'il faut savoir c'est que plus la prise en charge est tardive et plus le niveau de CD4 est
bas, plus la mortalité est importante.
Historique
Les premiers médicaments sont des inhibiteurs de la transcriptase inverse (reverse transcriptase) (enzyme
essentielle aux rétrovirus). Il y a eu d'abord des nucléosidiques (AZT, le premier, NRTI ...), puis des non
nucléosidiques agissant toujours au même endroit.

3
Les deuxièmes médicaments trouvés sont les inhibiteurs de protéase (« anti-protéases » ça passe aussi) : c’est la
fameuse trithérapie qui a fait décliner la mortalité de manière très nette : on donnait un médicament anti-
protéase et 2 inhibiteurs nucléotidiques (donc de la reverse transcriptase). Il a été mis en évidence par la suite des
médicaments qui permettent d'empêcher le virus d'entrer dans la cellule ; des inhibiteurs de la fusion, et puis
également des anti-CCR5 (inhibiteurs des corécepteurs, ne sont plus utilisés actuellement), puis, la grande
nouveauté, les inhibiteurs de l’intégrase (molécule très bien tolérée, très utilisée actuellement).
Description de la diapo :
Entre 1987 et 2015, on a quand même découvert énormément de médicaments : c’est la première fois pour
une pathologie que l’on en découvre autant en si peu de temps. Le premier médicament c’est l’AZT
(Zidovudine de sa DCI et RETROVIR de son nom commercial, premier médoc utilisé chez les séropositifs)
qui faisait très peu baisser la charge virale, puis 25 ans plus tard le VIDEX puis…la liste quoi)
Au début on ne donnait qu’un seul médicament mais ça faisait baisser de 0,5log la charge virale, ce qui est
très peu : le virus continuait à se répliquer (c’est là que l’on peut développer des mutations de résistance…).
C’est vers 1995 qu’on s’est aperçu que les monothérapies n’étaient pas la solution et qu’il fallait plutôt
associer des médicaments.
En rouge : les inhibiteurs de la réverse transcriptase.
En marron : à partir de 1995, on a les inhibiteurs non nucléosidiques (NEVIRAPINE,…), qu’on a associé
aux molécules en rouge.
En bleu : à partir de 1996-1997, on a les anti-protéases qui sont des médicaments très actifs (RITONAVIR,
INDINAVIR, etc) présentant quelques inconvénients (beaucoup de comprimés à prendre, intolérance
digestive) mais qui ont sauvés beaucoup de gens malgré tout.
Il y a ensuite eu des problèmes résistances, on a donc trouvés des médicaments qui fonctionnaient malgré les
résistances (KALETRA, ...)
Ensuite, la politique fut de mettre plusieurs molécules (médicaments) dans le même comprimé.
On a fait, par la suite, des progrès en termes de tolérance sur les anti-protéases.
En 2009, l’ATRIPLA : Première trithérapie en un comprimé par jour. Depuis, il y en a eu d’autres :
EVIPLERA.
En gris : depuis 2008, on a les anti-protéases.
Important : Il faut savoir que pendant longtemps on n’avait pas de médicaments puis on en avait un, on en
associait 2, mais ce n’était pas suffisant. Au début, il fallait associer au moins 3 médicaments pour rendre la
charge virale indétectable.
NB : Le prof précise qu’il ne faut pas savoir par cœur cette liste, mais elle traduit l’évolution des anti-
rétroviraux. C’est grâce, notamment, à l’étude du VIH, qu’on a pu découvrir énormément de molécules
anti- rétrovirales.
Ronéo 2013/2014 :
Ici tous les médicaments qu’on a depuis le début
- 1987 : le premier médicament est l’AZT
ensuite d’autres médicaments qui font partie des inhibiteurs de la reverse transcriptase (RTI)
Avant 1995 on avait très peu de médicaments : lourde mortalité
-1995-96 : on a mis en évidence des anti-protéases (PI)
Parallèlement on a mis en évidence des inhibiteurs de la reverse transcriptase qui n’était pas des
nucléosides (NNRTI)
- 1998 : on a mis en évidence un nouveau médicament : Efavirenz qui a bien amélioré les choses
-2000 : les médicaments sont toxiques, et comportent beaucoup de comprimés à prendre. Comme les gens
avaient du mal à prendre ces médicaments, des résistances sont apparues. Il fallait trouver des molécules
efficaces sur des virus résistants. C’est ce qui s’est passé pour Kaletra.

4
- 2001-2006 : on a cherché à développer des médicaments plus faciles à prendre : moins de comprimés, une
seule prise par jour et moins d’effets indésirables (EI). C’est le cas pour Tipranavir et Darunavir
On a mis en évidence un inhibiteur de fusion : Enfuvirtide : qui a permis de passer un certain cap. Car il y
avait des gens résistants et on n’avait pas de nouvelles classes qui pouvaient diminuer la charge virale (CV)
des patients.
- Récemment : on met en évidence des inhibiteurs d’intégrase (II): Raltégravir
Une grande nouveauté : mettre une tri-thérapie en 1cp/j : Atripla et Eviplera
- De 87-2015 : alors qu’il n’existait aucun médicament dirigé contre les virus, on a quand même mis en
évidence un certain nombre de molécules.
5 cibles virales et 6 classes d’antirétroviraux
Traitement ARV
Nb : On ne nous interrogera pas sur les
noms commerciaux mais plutôt sur les noms
de molécules (DCI).
Rassurez-vous, on n’insistera pas trop là-
dessus car il y en a beaucoup qu’on n’utilise
plus.
Deuxième colonne : on utilise plus ici que le
darunavir, ou Prezista
Nouveau médicament ajouté : GENVOYA (nouvelle molécule)
- INRT (inhibiteurs mono-nucléosidiques) : AZT (Rétrovir), médoc moins utilisé mais l’Epivir, le Ziagen,
Viread, eux sont encore largement utilisés.
- IP (inhibiteurs de protéases) : RTV (Norvir), les premiers ne sont plus utilisés car ont des effets
indésirables. On utilise encore l’Atazanavir, Reyataz et également beaucoup le Prezista, médicament qui a
considérablement augmenté le pronostic des patients. N’a plus une action ARV mais plutôt une action pour
booster les autres IP.
LPV (Kaletra), médicament dans les années 2000, qui a permis une amélioration de la prise et des molécules
plus puissantes. Beaucoup moins utilisé car on a des médicaments mieux tolérés.
- INNRT (inhibiteurs non nucléotidiques) : le Viramune est encore beaucoup utilisé
- IF (inhibiteur de fusion): qu’on utilise plus
- II (inhibiteur des intégrases) : RGV (Isentress), 2 nouveaux : Elvitegravir et Dolutégravir
- IE : inhibiteur du récepteur CCR5, peu utilisé
Nb : Une théorie explique que les noms de ces médicaments sont directement tirés d’un catalogue IKEA.
1987-2016 : Evolution des problématiques et exigences
Entre 1987 et 2006, on voulait surtout de la puissance anti-rétrovirale, mais on ne l’avait pas car on
utilisait qu’un seul traitement.

5
Puis lorsqu’on a eu la puissance, ce qui
comptait c’était la tolérance : les premières
anti-protéases étaient mal tolérées
(vomissements).
Ensuite on a distingué la tolérance à court
terme de celle à long terme (certaines
molécules sont toxiques à long terme).
On s’est aussi intéressé à la facilité de
prise : en 1995, les gens parfois avaient 10 à
12 comprimés à prendre.
Aujourd’hui, on a des médicaments avec une puissance élevée, pour rendre la charge virale indétectable,
pas ou peu de résistance, une tolérance à court et long terme, une facilité de prise et pas ou peu
d’interaction médicales (notre population vieillit, susceptible de prendre d’autres médicaments qui peuvent
interférer avec l’effet des ARV).
Ronéo 2014-2015 : Au début, l’utilisation seule de l’AZT était insuffisante même si c’était très puissant :
beaucoup d’effets secondaires (faisait diminuer un petit peu la CV). Avec le temps, les labos ont cherché à
diminuer le nombre de comprimés et diminuer les effets secondaires à long terme (les anciennes anti-
protéases étaient pourvoyeuses de lipodystrophies.)
Question : Concernant les personnes ayant le facies VIH (joues creusées), c’est le traitement qui fait ça ou la
maladie elle-même ? Non c’est souvent le traitement, particulièrement le Zerite, la Stavudine (plus utilisés).
Ronéo 2013-2014 : Quand il y a eu une nouvelle molécule : le videx. Soit on remplace l’AZT par le Videx,
sinon on associe les 2 molécules. Mais c’était 2 INRT (donc de la même classe) et c’est toujours insuffisant
en puissance. Lorsqu’on a eu l’IP, on a pu l’associer aux 2 autres molécules = tri-thérapie. Ce n’est qu’à ce
moment qu’on a eu des médicaments plus puissants. On a rendu ainsi la CV indétectable (ça ne veut pas dire
qu’il n’y a pas de virus dans le sang, mais qu’il y a peu de copies dans le sang), on n’a donc pas de baisse
des Ly CD4, et une immunité qui remonte.
Objectif du traitement et recommandations
Objectif du traitement : CD4 > 500/mm3 chez tous les patients pris en charge. La mortalité est alors
comparable à celle de la population générale après 6 ans de suivi sous traitement. On incitera aussi le patient
à une initiation précoce du traitement, afin de faciliter l’objectif fixé.
Aujourd’hui, on traite tout le monde.
On considère que si les gens n’ont pas de co-morbidités, n’ont pas été ID trop longtemps (reste le plus
souvent > 500/mm3) que leur espérance de vie est comparable à celle de la population générale.
Ce qui a vraiment changé : on a des recommandations pour traiter tout le monde. Même les gens qui ont un
taux de CD4 élevé.
Question : Pourquoi traiter les personnes avec un nombre de CD4 au-dessus de 500/mm3 ? L’objectif est
de préserver le nombre de CD4 de la personne au-dessus de 500/mm3 .
Nouvelles recommandations pour l’initiation d’un traitement ARV chez l’adulte asymptomatique :
- Instaurer un traitement ARV chez toutes les personnes vivant avec le VIH quelque soit le nombre de Ly
CD4. Le niveau de preuve de cette recommandation dépend de la situation du patient à l’initiation du
traitement : plus le taux de CD4 est bas, plus il y a une indication claire à traiter.
- On traite également les gens qui ont une primo-infection au VIH : pour éviter que les réservoirs ne
s’imprègnent trop de l’ADN du virus. Moins d’imprégnation du virus dans les réservoirs.
- La transmission du VIH est rendue quasi-nulle lorsqu’on a une CV (charge virale) indétectable. Pour
diminuer la transmission du VIH il faut donc traiter tout le monde (réel bénéfice).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%