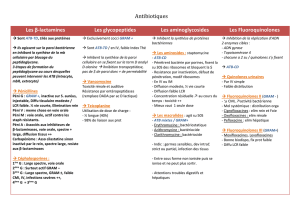
Syndrome méningé fébrile : hémocultures et analyse

Syndrome méningé fébrile :
Syndrome méningé fébrile :
Hémocultures
Hémocultures
et
et
analyse bactériologique du LCR
analyse bactériologique du LCR
Dr Frédérique Gouriet
Dr Frédérique Gouriet

Identification du flacon +++
Réaliser un prélèvement de qualité
Éviter les contaminants et travailler en sécurité
Prélever une quantité de sang suffisante
!
"#$%&'#()*+,"-
*"""
./
*"20 à 30 ml &
0$1#2
23)+*,"-2"
$1#"(1-2 ml&
Réalisation des hémocultures
Réalisation des hémocultures

Nombre d’hémocultures :
Au nombre de 3
Distinguer les bactériémies vraies des contaminations&
4""" 555
Bacillus2CorynebacteriumPropionibacterium2
#6"7sont des contaminants dans plus de
95% des cas&
!7'/"-&
8"$"22
"7&
Réalisation des hémocultures
Réalisation des hémocultures

Détection de la croissance
Détection de la croissance
bactérienne
bactérienne
9*:;<9:=
9
>?
<+;)"
9"@
Pas d’examen direct
Pas d’examen direct
!#%"
#"Listeria Brucella ? )

A%%
B?
1. Réaliser un état frais
=C"?(
"Campylobacter
HEMOCULTURES
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%