Accompagnement personnalisé n 1

Terminale S
Accompagnement Personnalisé n°1
M.Meyniel 1/1
LA QUANTITE DE MATIERE ET LES TABLEAUX D’AVANCEMENT
Exercice 1 : Combustion du propane
Par une chaude journée d’été, Perline souhaite faire cuire des brochettes de poulet avec des poivrons. Elle
utilise pour cela un barbecue à gaz et en consomme 25.101 g.
1. Préciser le comburant et combustible utilisés. On précisera les formules brutes correspondantes.
2. Quels sont les espèces chimiques produites ? Comment les mettre en évidence ?
3. Peut-on parler de transformation chimique ?
4. Etablir l’équation de la réaction.
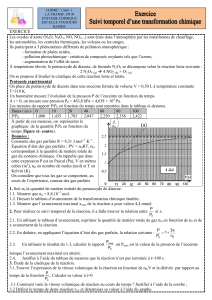
5. Déterminer la composition, en quantité de matière, du système à l’état final à l’aide du tableau
d’avancement suivant, sachant que 25 mol de dioxygène ont été consommées.
6. On s’aperçoit que tout le gaz n’a pas été consommé. Il convient de réduire notamment le débit.
Dans ce cas pour la même quantité de gaz libéré, quelle serait la quantité de dioxygène consommée ?
Comment qualifie-t-on alors le mélange ?
Exercice 2 : Formation de rouille
Dans sa description la plus simple, la rouille est un oxyde de fer de formule brute Fe2O3 (s). Elle résulte de
l’action du dioxygène O2(g) sur le fer solide Fe(s). On introduit un échantillon de masse m = 25,0 g de fer solide
dans un récipient contenant un volume V = 20,0 L de dioxygène à la température de 20 °C et à la pression
atmosphérique (1,0 bar).
1. Calculer les quantités de matière des réactifs
Pour les gaz, on utilisera l’équation
d’état des gaz parfaits : P × V = n × R × T
2. Compléter le tableau suivant :
3. Déterminer l’avancement maximal de la réaction et le réactif limitant.
4. Calculer les quantités de matière des espèces chimiques présentes à l’état final.
5. En déduire la masse finale mf(Fe2O3) de rouille obtenue.
Avancement
Etat
initial
Etat
intermédiaire
Etat
final
Équation de la réaction
4 Fe (s) + 3 O2 (g) 2 Fe2O3 (s)
État du
système
Avancement
Quantités de matière (en mol)
État initial
En cours de
transformation
État final
P la pression en pascal (Pa)
V le volume en m3
T la température en kelvin K. T(K) = T(°C) + 273,15
R la constante des gaz parfaits R = 8,31 SI
n la quantité de matière de gaz (en mol)

Terminale S
Accompagnement Personnalisé n°1
M.Meyniel 2/1
Exercice 3 : Synthèse de l’ammoniac
La synthèse de l’ammoniac NH3 se fait par la réaction de deux gaz, le diazote N2 et le dihydrogène H2 sous
une pression de 300 bars et une température de 500 °C.
1. Ecrire l’équation chimique de la réaction.
2. On fait réagir 5 mol de diazote avec 9 mol de dihydrogène. Ecrire l’état initial et l’état intermédiaire du
tableau d’avancement.
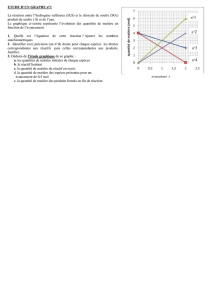
3. Sur le graphique ci-dessous, tracer les droites représentant l’évolution des quantités de matière en fonction
de l’avancement x. (à l’état intermédiaire)
4. Rappeler la définition d’un réactif limitant. A l’aide du graphique tracé, déterminer le réactif limitant de
cette transformation.
5. En déduire la valeur de l’avancement maximal.
6. En utilisant le graphique, effectuer le bilan de matière de l’état final.
Exercice 3 : Synthèse de l’ammoniac
La synthèse de l’ammoniac NH3 se fait par la réaction de deux gaz, le diazote N2 et le dihydrogène H2 sous
une pression de 300 bars et une température de 500 °C.
1. Ecrire l’équation chimique de la réaction.
2. On fait réagir 5 mol de diazote avec 9 mol de dihydrogène. Ecrire l’état initial et l’état intermédiaire du
tableau d’avancement.
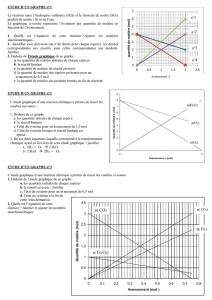
3. Sur le graphique ci-dessous, tracer les droites représentant l’évolution des quantités de matière en fonction
de l’avancement x. (à l’état intermédiaire)
4. Rappeler la définition d’un réactif limitant. A l’aide du graphique tracé, déterminer le réactif limitant de
cette transformation.
5. En déduire la valeur de l’avancement maximal.
6. En utilisant le graphique, effectuer le bilan de matière de l’état final.
avancement
(mol)
quantité de matière
(mol)
avancement
(mol)
quantité de matière
(mol)
1
/
2
100%