Nouveaux traitements pour le diabète : la génération de nouvelles

Orientations futures
34
Octobre 2004 Volume 49 Numéro 3
34
(
)
Nouveaux traitements pour le diabète :
la génération de nouvelles cellules
productrices d’insuline
[ Denise L Faustman
Une nouvelle génération de traitements pour le diabète de type 1 naîtra
probablement de notre propre organisme. Nous savons qu’un grand
nombre de types de cellules a la capacité de se régénérer. Bien que
certaines de ces cellules se trouvent en dehors du pancréas, leur
capacité régénérative peut être exploitée pour réapprovisionner les
îlots de Langerhans producteurs d’insuline du pancréas qui sont
détruits chez les personnes atteintes de diabète. Dans cet article,
Denise Faustman se penche sur les avantages et pièges potentiels
de quatre thérapies basées sur la biologie, qui profitent toutes de la
propre capacité de guérison et de renouvellement de l’organisme.
>>
Les médias ont beaucoup parlé
du potentiel des cellules souche
embryonnaires pour le traitement du
diabète de type 1 (voir Nouvelles en
bref dans ce numéro de Diabetes Voice).
Loin des projecteurs et au coeur même
de la recherche, on trouve également
un certain nombre d’autres thérapies
prometteuses basées sur la biologie.
La nouvelle génération de thérapies est
répartie en quatre catégories principales :
U les cellules souche issues d’embryons
U les cellules souche issues
d’humains adultes
U les facteurs de croissance
U la régénération spontanée.
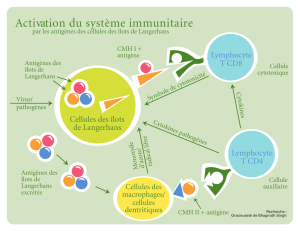
Le diabète de type 1 est provoqué par
une attaque du système immunitaire
contre les cellules bêta productrices
d’insuline du pancréas. Même si l’attaque
immunitaire ne peut pas être entièrement
arrêtée dans le diabète de type 1, on peut
espérer que ces nouvelles thérapies
puissent également fonctionner dans
le traitement du diabète de type 2.
Il faut espérer que la
nouvelle génération
de thérapies puisse
fonctionner dans
le traitement du
diabète de type 2.
Lorsque l’on étudie les avantages de
ces nouvelles thérapies, il ne faut pas
oublier que, pour être efficace, toute
thérapie cellulaire (impliquant ou
non des cellules souche) doit être :
U
robuste : offrir une grande
proportion de cellules qui
produisent des cellules bêta des îlots
plutôt que d’autres types de cellules
U
stable : rester une cellule bêta
de l’îlot, sans se transformer
en une cellule cancéreuse ou
un autre type de cellule
U
durable : maintenir la
production d’insuline pendant
de longues périodes
U
fonctionnelle : entraîner la
normalisation des taux de glycémie.

Orientations futures
35
Octobre 2004 Volume 49 Numéro 3
35
(
)
Les cellules souche
issues d’embryons
Les cellules souche embryonnaires sont
extraites d’oeufs humains fertilisés à un
stade très précoce, 4 à 5 jours après
la conception, lorsque l’embryon est
constitué d’environ 150 cellules. A ce
stade, connu sous le nom de stade
blastocyste, l’embryon est composé
d’une sphère de cellules autour d’un
noyau contenant du fluide et un
agrégat de cellules à une extrémité.
Ces cellules ont deux qualités
fondamentales : elles peuvent se diviser
indéfiniment et se transformer en une large
variété de types de cellules, notamment
des cellules cérébrales, sanguines ou
pancréatiques. C’est ce qui se produit
dans l’utérus d’une femme pendant
le développement du foetus. Dans le
domaine du diabète, une étude a prétendu
que les cellules souche embryonnaires
pouvaient être amenées à former des
cellules bêta productrices d’insuline.
Toutefois, plusieurs autres études n’ont
pas réussi à confirmer ces conclusions.
Bien que la capacité des cellules souche
embryonnaires à former des organismes
complets ou des lignages multiples soit
indéniable, la recherche n’en est encore
qu’à ses débuts. Nous devons encore
confirmer que des lignes de cellules stables
peuvent être produites. Un problème
fondamental concerne l’instabilité des
cellules souche embryonnaires en culture.
Puisque les cellules souche embryonnaires
ont la capacité de proliférer et de se
différentier, elles ont également le potentiel
de se transformer en cellules hautement
indésirables. La recherche a montré que les
cellules souche embryonnaires pouvaient
se transformer en cellules tumorales.1
Si les cellules souche embryonnaires
arrivent à éviter cela, elles doivent
continuer à conserver leur identité
indéfiniment en tant que cellules bêta
régulatrices de la sécrétion d’insuline.
Les cellules souche
issues d’adultes
La recherche sur les cellules souche
adultes est plus avancée. Ces cellules
sont par nature plus stables que les
cellules souche embryonnaires, mais elles
présentent également un certain nombre
d’inconvénients devant être surmontés
pour pouvoir les utiliser dans le cadre
d’un traitement efficace du diabète.
Le terme “adulte” est quelque peu
trompeur. Les cellules souche adultes
proviennent de tissu (adulte) différencié
trouvé sur une personne de n’importe quel
âge (enfant, adolescent ou adulte). Bien
que ces cellules ne puissent pas former
des organismes complets ou n’importe
quel type de tissus ou de cellules, elles
peuvent évoluer vers un certain nombre
de types de cellules différents. Par exemple,
une cellule souche adulte productrice
de sang (“hématopoïétique”) extraite du
sang ou de la moelle épinière peut devenir
un globule rouge ou plusieurs types de
globules blancs. A part le pancréas, au
moins 10 tissus connus de l’organisme
humain contiennent des cellules souche
adultes, notamment le poumon, la peau,
les intestins et l’oreille interne.2
L’application de la recherche sur les cellules
souche adultes est en cours sur des
animaux modèles de diabète de type 1. Au
moins sept études publiées au cours des
8 dernières années ont produit des types
de cellules souche d’îlots adultes différents,
potentiellement capables de produire de
l’insuline, chez des animaux ou des humains.
La recherche la plus avancée concerne
les cellules souche hématopoïétiques
issues de la moelle épinière.
Les cellules souche hématopoïétiques,
en plus de produire plusieurs cellules
sanguines, peuvent former des petites
parties d’organes adultes, notamment
le cerveau, le coeur ou l’intestin. De
plus, certains affirment que la moelle
épinière contient d’autres types de
cellules souche ; ces cellules peuvent
aider directement ou indirectement à
la génération d’îlots de Langerhans.
La moelle épinière
contient des cellules
souche qui peuvent
favoriser directement ou
indirectement la génération
d’îlots de Langerhans.
La transformation de cellules souche
hématopoïétiques adultes en cellules
productrices d’insuline a des inconvénients.
Il est possible que les cellules souche
hématopoïétiques ne soient pas
suffisamment robustes : une fraction
insuffisante de cellules récoltées peut
être transformée en îlots de Langerhans.
Certains affirment que les cellules souche
hématopoïétiques peuvent contribuer
à faciliter la régénération d’îlots de
Langerhans sans devenir directement
des îlots de Langerhans. Cependant, il
risque d’être impossible de récolter
suffisamment de cellules souche spécifiques
de la moelle épinière pour produire assez
d’insuline pour modifier la progression
du diabète et maintenir la production
d’insuline pendant plusieurs années.
Les cellules spléniques comme
source de cellules souche adultes
Jusqu’il y a peu, la rate était considérée
comme une source peu probable de

Orientations futures
36
Octobre 2004 Volume 49 Numéro 3
36
(
)
cellules souche adultes. Les scientifiques
pensaient que la rate ne contenait qu’un
réservoir d’un type particulier de globule
blanc, le lymphocyte. Toutefois, à l’heure
actuelle, plusieurs laboratoires, dont le
mien, qui travaillent sur des animaux
modèles de diabète de type 1 et étudient
le développement des îlots normaux
chez les souris, ont découvert un rôle
possible des cellules spléniques dans la
formation des îlots de Langerhans. De
plus, après avoir été injectées dans le flux
sanguin, les cellules souche de la rate sont
capables de trouver leur chemin vers le
pancréas. Nous avons démontré que ces
îlots de Langerhans nouvellement formés
étaient durables et fonctionnels et qu’ils
continuaient de secréter de l’insuline tout
au long de l’âge adulte.3 Elles semblent
donc remplir deux des critères mentionnés
ci-dessus : la durabilité et la fonctionnalité.
On ne sait pas encore si cette nouvelle
population de cellules souche adultes
existe chez les humains. On ignore
également si elles jouent un rôle dans
le renouvellement cellulaire normal des
îlots dans le pancréas ou si leur rôle se
limite uniquement à la régénération des
îlots pendant ou après une maladie.
La recherche n’en est qu’à ses débuts.
Personne n’affirme que les greffes de cellules
spléniques sont prêtes pour des essais
cliniques. Le problème clé est la prévention
de l’attaque des îlots de Langerhans par le
système immunitaire. Mais si nous parvenons
à surmonter cet obstacle majeur, l’utilisation
de cellules souche adultes extraites de la
rate pour régénérer des îlots et produire
de l’insuline deviendra une option réaliste.
Facteurs de croissance
La recherche, tant sur les animaux que
sur les humains, soutient à présent une
approche totalement différente de la
régénération d’îlots de Langerhans, à
savoir la purification des facteurs de
croissance naturels et l’utilisation de ces
derniers pour stimuler la régénération
des îlots de Langerhans. Cette voie de
recherche propose d’utiliser des facteurs
de croissance comme médicaments
pour cajoler les cellules souche résidant
dans le pancréas malade ou ailleurs dans
l’organisme afin qu’elles deviennent
des îlots de Langerhans producteurs
d’insuline. Au moins cinq facteurs de
croissance différents sont candidats à la
stimulation de la régénération d’îlots de
Langerhans. L’utilisation de l’un de ces
facteurs (l’exendin-4, voir l’article de
El-Ouaghlidi et Nauck dans le numéro
de juillet 2004 de Diabetes Voice) a atteint
le stade des essais cliniques humains et
beaucoup d’autres sont en train d’être
identifiés à travers la recherche.
Les facteurs de croissance évitent la greffe
de tissus et ne touchent que la croissance
et la maturation des cellules. Toutefois, à
long terme, ils pourraient provoquer des
tumeurs ou épuiser l’approvisionnement
de cellules souche dans le pancréas. Cela
constitue un risque, en particulier dans le
diabète de type 1, où l’attaque du système
immunitaire semble être stimulée par un
nouvel approvisionnement d’îlots cibles.
Régénération spontanée
Imaginez un traitement capable de
régénérer des îlots dans l’organisme
sans avoir recours à des médicaments
ou des greffes. Les données scientifiques
se multiplient indiquant que, dans le
diabète de type 1, les îlots de Langerhans
sont constamment réapprovisionnés,
même à l’âge adulte, à la fois par des
populations de cellules souche adultes
(dans le pancréas ou peut-être la rate) et
par la division cellulaire des cellules bêta
existantes.4 Chez des animaux modèles,
des chercheurs ont démontré que, lorsque
la maladie auto-immune sous-jacente
était éliminée, les îlots se renouvelaient
très rapidement dans le pancréas puis
produisaient et secrétaient activement de
l’insuline. Cela ne se produit qu’à travers
un contrôle strict des taux de glycémie.5
Imaginez un traitement
capable de régénérer des
îlots sans avoir recours
à des médicaments
et des greffes.
Dans le cadre du diabète, un contrôle strict
de la glycémie est fondamental pour la
prévention des complications ; les dernières
découvertes suggèrent qu’un contrôle
strict pourrait avoir un autre avantage :
celui d’ouvrir la voie à la régénération. En
effet, la recherche impliquant des personnes
atteintes de diabète depuis de nombreuses
années indique que les îlots de Langerhans
restant dans le pancréas essaient de se
régénérer ; ils se forment mais ils sont
ensuite détruits par le système immunitaire.
Toutefois, bien que la stimulation de la
régénération spontanée offre de nombreux
avantages, il est possible que l’évolution
temporelle naturelle de la régénération
soit trop longue ou pas assez robuste pour
rétablir des taux de glycémie normaux.
Conclusions
Les thérapies à base de cellules souche
et les autres thérapies basées sur la
biologie ont un énorme potentiel pour la
guérison du diabète de type 1, à condition
de réussir à contrôler l’attaque auto-
immunitaire sous-jacente. Le domaine
des thérapies cellulaires est prometteur,
grâce aux années de progrès avec les
cellules souche embryonnaires et un large

Orientations futures
37
Octobre 2004 Volume 49 Numéro 3
37
[ Denise L Faustman
Denise L Faustman est Professeur de
médecine auprès de la Harvard Medical
School et Directrice des laboratoires
d’immunobiologie du Massachusetts
General Hospital, Charlestown, Etats-Unis.
Références
1 Draper JS, Smith K, Gokhale P, et al. Recurrent
gain of chromosomes 17q and 12 in cultured
human embryonic stem cells. Nat Biotechnol
2004; 22: 53-4.
2 Anderson DJ, Gage FH and Weissman IL. Can
stem cells cross lineage boundaries? Nat Med
2001; 7: 393-5.
3 Kodama S, Kuhtreiber W, Fujimura S, Dale EA
and Faustman DL. Islet regeneration during the
reversal of autoimmune diabetes in NOD mice.
Science 2003; 302: 1223-1227.
4 Dor Y, Brown J, Martinez OI and Melton DA.
Adult pancreatic beta-cells are formed by
self-duplication rather than stem-cell
differentiation. Nature 2004; 429: 41-6.
5 Ryu S, Kodama S, Ryu K, Schoenfeld DA
and Faustman DL. Reversal of established
autoimmune diabetes by restoration of
endogenous beta cell function. J Clin Invest
2001; 108: 63-72.
éventail de cellules souche adultes. Une
étape importante a été franchie avec les
cellules souche adultes extraites de la rate,
un organe dont on ignorait jusque là qu’il
contenait des cellules souche permettant
la création d’îlots. L’utilisation de facteurs
de croissance et de la stimulation de la
régénération spontanée est également
extrêmement prometteuse pour la nouvelle
génération de traitements pour le diabète.
1
/
4
100%