DST 5

CLASSE DE PREMIÈRE S Le : 23 mai 2007
Durée : 3 h 00
Physique-Chimie
DEVOIR SUR TABLE N° 5
TOUT DOCUMENT INTERDIT.
L’usage de calculatrices scientifiques à mémoire est autorisé.
Les résultats numériques doivent être précédés d’un calcul littéral.
La présentation et la rédaction font partie du sujet et interviennent dans la notation.
L’épreuve est notée sur 16 points auxquels s’ajouteront les points d’épreuve pratique sur 4 points.
I ] CHIMIE : sur 7 points. SYNTHÈSE DE LA MENTHONE
On peut fabriquer la menthone par oxydation ménagée du menthol, molécule qui donne à la menthe son arôme.
On fournit les données suivantes.
La menthone est peu soluble dans l’eau, tandis que menthol, éthanol,
éthanal et acide éthanoïque sont très solubles dans ce solvant.
La menthone possède une densité par rapport à l’eau de 0,890.
1. Donner les formules topologiques du menthol et de la menthone.
2. Identifier et représenter les groupes caractéristiques présents dans ces
deux molécules.
3. Mode opératoire.
On oxyde un échantillon de menthol par une solution acidifiée de
permanganate de potassium. Pour cela on introduit dans un ballon une
masse : m = 11,7 g de menthol et un volume : V = 160 mL de solution
oxydante de concentration : C = 0,200 mol.L-1. On chauffe à reflux pendant
vingt minutes.
À la fin du chauffage, on laisse refroidir le mélange à l'air puis on détruit
l'excès d'oxydant avec quelques gouttes d'éthanol ; les produits ainsi formés sont
sans incidence pour la suite des opérations. On transvase ensuite le mélange
obtenu dans une ampoule à décanter : deux phases apparaissent. On élimine la
phase aqueuse, puis on lave la phase organique avec 20 mL de solution saturée d'hydrogénocarbonate de sodium. Lorsque
cesse l'effervescence, on élimine la phase aqueuse et on rince avec 20 mL d'eau distillée. On élimine à nouveau la phase
aqueuse, on récupère la phase organique sur des cristaux de chlorure de calcium anhydre afin de la sécher. Après filtration,
on recueille une masse : m' = 7,45 g de menthone.
3.1. Dessiner le schéma légendé du montage à reflux.
3.2. Quel intérêt présente ce dispositif ?
3.3. « À la fin du chauffage, on laisse refroidir le mélange à l'air puis on détruit l'excès d'oxydant avec quelques
gouttes d'éthanol ». Donner les formules semi-développées et les noms des produits organiques obtenus à
partir de l’éthanol dans ces conditions.
3.4. Pourquoi ces produits organiques ne perturbent-ils pas la séparation de la menthone en fin de réaction ?
3.5. Dessiner l’ampoule à décanter et justifier l’organisation de son contenu.
3.6. Quel type de réaction se produit par lavage du milieu réactionnel avec l’hydrogénocarbonate de sodium
(Na+aq + HCO3–aq). Quel gaz est responsable de l’effervescence observée ?
4. Identification du produit et rendement de la synthèse.
4.1. Afin de vérifier la pureté du produit, on réalise une chromatographie sur couche
mince (C.C.M.). On obtient le chromatogramme ci-contre.
4.1.1. Interpréter ce chromatogramme.
4.1.2. Déterminer les rapports frontaux des deux espèces présentes.
4.2. L’équation chimique de la réaction de synthèse s’écrit :
5 menthol + 2 MnO4–aq + 6 H+aq → 5 menthone + 2 Mn2+aq + 8 H2O
4.2.1. Déterminer les quantités de matière des réactifs introduits.
4.2.2. Montrer que le permanganate est effectivement en excès.
4.2.3. Si le rendement de la synthèse avait été de 100 %, quelle masse de
menthone aurait-on obtenue ?
4.2.4. Quel est le rendement de cette synthèse ?
... / ...

II ] PHYSIQUE : sur 4,5 points. CIRCUITS DÉRIVÉS
Dans le circuit électrique figuré ci-contre, la puissance PR dissipée par le
conducteur ohmique de résistance R, égale à 27,0 Ω, est : PR = 2,43 W.
Les deux moteurs identiques M1 et M2 ont une f.c.é.m. de 3,00 V et une résistance
interne égale à 3,00 Ω. Le générateur G possède une f.e.m. E et une résistance interne r.
1. Reproduire le schéma donné et y faire figurer les flèches de tensions et
d’intensités lorsque le dispositif est en fonctionnement.
2. Déterminer la valeur I1 de l’intensité du courant électrique qui traverse le moteur M1.
3. Calculer la valeur I2 de l'intensité du courant électrique qui traverse le moteur M2.
4. Quelle puissance PG le générateur fournit-il au reste du circuit ?
5. En fait, le générateur est une batterie électrochimique. L’énergie chimique totale disponible en son sein, WG, est
égale à 39,0 kJ lorsqu'il fonctionne durant quinze minutes.
5.1. Quelle puissance totale PG tot peut fournir le générateur ?
5.2. En déduire la valeur de sa f.é.m. E.
5.3. Calculer la valeur de sa résistance interne r.
5.4. Définir, puis calculer, le rendement de ce circuit électrique.
6. On remplace à présent les deux moteurs M1 et M2 par deux conducteurs ohmiques de résistances identiques : r’ = 3,00 Ω.
6.1. Déterminer la résistance équivalente au nouveau circuit purement résistif ainsi obtenu.
6.2. Quelle puissance P’G le générateur va-t-il fournir au circuit dans ces nouvelles conditions ?
6.3. Sachant que ce dispositif simule un fonctionnement « moteurs bloqués », proposer une conclusion.
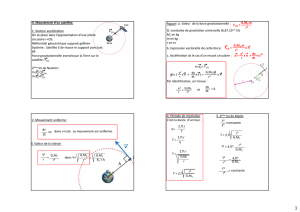
III ] PHYSIQUE : sur 4,5 points. SATELLITES DE LA TERRE
Les mouvements des satellites sont étudiés dans le référentiel géocentrique. Chaque satellite est assimilé à son
centre d’inertie S, de masse mS. Sauf indication contraire, on ne tiendra pas compte de la résistance de l'air.
Données Rayon de la Terre : RT = 6,40.103 km ; masse de la Terre : MT = 6,00.1024 kg.
Constante de gravitation universelle : G = 6,67.10-11 uSI.
1. Dans le référentiel géocentrique, le satellite d'observation « Spot » évolue sur une orbite circulaire à une altitude : z = 820
km. 1.1. Définir le référentiel géocentrique, et dire dans quelle condition on peut le considérer comme galiléen.
1.2. Rappeler l’énoncé de la loi de gravitation universelle de Newton. On pourra s’aider d’un schéma.
1.3. Donner l'expression littérale de l’intensité FT/S de la force de gravitation exercée par la Terre sur le satellite
« Spot », en fonction de RT, mS, MT, z et G.
1.4. Calculer le rapport FT/S / mS, qui représente l’intensité du champ de gravitation gS au point S. Comparer gS à
l'intensité g0 de la pesanteur au niveau du sol.
1.5. L'énergie potentielle de pesanteur du satellite ne peut pas être calculée ici avec l'expression classique :
Epp = mS g z. Expliquer pourquoi.
1.6. À l'altitude où se trouve le satellite, la résistance de l'air résiduel est négligeable devant les autres forces.
Montrer alors que la valeur de la vitesse du satellite est constante sur sa trajectoire circulaire.
1.7. La résistance de l'air résiduel provoque en réalité une lente perte d'altitude des satellites. En même temps, la
valeur de leur vitesse augmente. Comment évoluent alors l'énergie cinétique du satellite, son énergie
potentielle de pesanteur et la somme de ces deux énergies ? Que devient l'énergie transférée ?
2. Aux grandes altitudes, l'énergie potentielle de pesanteur d'un satellite de masse mS, placé à l'altitude z, est donnée
par l'expression : EPP = G mS MT ( TT
11
RRz
−
+ ), en prenant la surface de la Terre pour origine des altitudes.
Afin de placer un satellite de télécommunication à une altitude za = 3,60.107 m, il est d'abord amené à une altitude
zP = 2,00.105 m où un moteur lui communique en un temps bref une vitesse de valeur VP.
2.1. Calculer la variation de l'énergie potentielle de pesanteur d'un satellite de masse : mS = 1,00.103 kg au cours
du transfert de l'altitude zP à l'altitude za.
2.2. Calculer la valeur de la vitesse VP pour que le satellite atteigne l'altitude za avec la valeur Va = 1,60 km.s-1 de
sa vitesse.
G
1
/
2
100%