RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1

RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
1. DÉNOMINATION DU MÉDICAMENT
KCl 7,45 % B. Braun, solution à diluer pour perfusion
KCl 14,9 % B. Braun, solution à diluer pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
7,45 % 14,9 %
Chlorure de potassium 1,49 g/20 ml 3,725 g/50 ml 1,49 g/10 ml 2,98 g/20 ml
Electrolyte 1 ml = 1 mmol (mEq)K+ 1 ml = 2 mmol (mEq)K+
pH 4,5 – 7,5 4,5 – 7,5
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution à diluer pour perfusion
4. DONNÉES CLINIQUES
4.1 Indications thérapeutiques
•Hypokaliémie
•Alcalose hypochlorémique
4.2 Posologie et mode d’administration
Posologie
La dose doit être ajustée en fonction du taux actuel d’électrolytes sériques et du statut acido-
basique.
La posologie est directement liée aux besoins du patient.
Adultes
Posologie pour le traitement d’un déficit potassique asymptomatique modéré et pour l’entretien
:
La quantité requise en vue de la correction d’un déficit potassique modéré et de l’entretien peut
être calculée à l’aide de la formule suivante :
* Indique le volume de liquide extracellulaire
** Doit être 4,5 mmol/l
mmol K+ requis = (poids corp. [kg] x 0,2)* x 2 x (K+ sériquecible** - K+ sérique actuel [mmol/l])

Dose quotidienne maximale (en cas d’hypokaliémie symptomatique sévère ou de pertes importantes,
par exemple)
Jusqu’à 2-3 mmol/kg PC/jour
Vitesse maximale de perfusion
Jusqu’à 20 mmol de potassium par heure chez les adultes (correspond à 0,3 mmol de potassium/kg
PC/heure).
Si le taux sérique de potassium est inférieur à 2 mmol/l, la vitesse de perfusion maximale peut être
de 40 mmol par heure.
Population pédiatrique
Le volume et la vitesse de perfusion dépendent des besoins du patient individuel.
La dose quotidienne ne peut pas excéder 2-3 mmol/kg PC ou 40 mmol/m².
Population âgée
Cf. adultes.
Circonstances particulières
Les variations de l’équilibre acido-basique influencent les concentrations plasmatiques. Le besoin
de potassium est accru afin de compenser l’acidocétose chez les patients diabétiques et lors de
l’administration de glucose/insuline.
Mode d’administration
Utilisation intraveineuse. Administration en perfusion intraveineuse lente après dilution des solutions
à perfusion.
En principe, la concentration de potassium dans la solution à perfusion ne peut pas excéder
40 mmol/l.
Si le taux sérique de potassium est inférieur à 2 mmol/l, la concentration maximale de potassium
dans la solution à perfusion peut être de 80 mmol/litre.
Pour les solutions vectrices adéquates et d’autres instructions d’utilisation, voir rubrique 6.6.
En principe, des pompes à perfusion doivent être utilisées lors de la perfusion de potassium dans le
cadre de la mise en place d’un traitement de correction.
4.3 Contre-indications
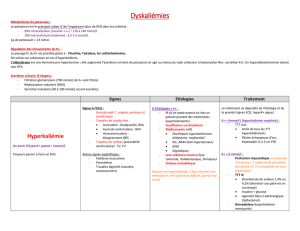
•Hyperkaliémie
•Hyperchlorémie
•Acidose
•Troubles accompagnant souvent l’hyperkaliémie, tels que :
- déshydratation
- excrétion rénale réduite
- maladie d’Addison
- adynamie épisodique héréditaire (maladie de Gamstorp)
- anémie falciforme
4.4 Mises en garde spéciales et précautions d’emploi
La prudence s’impose lors de l’administration d’une solution concentrée de chlorure de potassium
dans les cas suivants :
- décompensation cardiaque ;
Page 2 of 8

- traitement simultané par diurétiques d’épargne potassique, antagonistes de
l’aldostérone, inhibiteurs de l’ACE ou médicaments potentiellement néphrotoxiques
(anti-inflammatoires non stéroïdiens, par exemple).
L’administration de perfusions contenant du potassium doit être arrêtée en cas de signes
d’insuffisance rénale.
L’arrêt soudain de l’administration de potassium peut provoquer une hypokaliémie nette, laquelle
peut entraîner une augmentation de la toxicité des glycosides cardiaques pris simultanément.
Des modifications caractéristiques sont observables à l’ECG lorsque l’équilibre potassique est
perturbé (hypokaliémie ou hyperkaliémie). Toutefois, il n’existe aucun lien direct entre les
modifications de l’ECG et la concentration de potassium dans le sang.
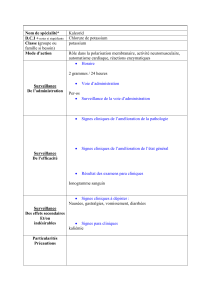
Le suivi clinique doit porter sur le contrôle des électrolytes sériques et de l’équilibre acido-basique.
Il convient de s’assurer que la solution est administrée en intraveineuse, car l’administration
paraveineuse peut entraîner une nécrose des tissus.
Ne pas injecter la solution concentrée.
4.5 Interactions avec d’autres médicaments et autres formes d’interaction
Glycosides cardiaques (digitaliques)
Une augmentation de la concentration extracellulaire de potassium réduit l’effet des glycosides
cardiaques, tandis qu’une diminution renforce l’effet arythmogène des glycosides cardiaques.
Administrer avec prudence aux patients sous traitement digitalique.
Médicaments réduisant l’excrétion du potassium
Les diurétiques d’épargne potassique, les antagonistes de l’aldostérone, les inhibiteurs de l’ACE, le
tacrolimus, la ciclosporine, les anti-inflammatoires non stéroïdiens, les analgésiques périphériques et
la prise d’héparine à long terme réduisent l’excrétion rénale du potassium. Une hyperkaliémie grave,
ayant des effets secondaires sur le rythme cardiaque, peut se manifester en cas d’administration
simultanée avec le chlorure de potassium.
Suxaméthonium
Une hyperkaliémie grave, ayant des effets secondaires sur le rythme cardiaque, peut également se
manifester en cas d’administration simultanée de suxaméthonium et de potassium.
4.6 Fertilité, grossesse et allaitement
Fertilité
Aucune donnée disponible.
Grossesse
Aucune donnée issue d’études cliniques contrôlées relatives aux grossesses exposées n’est disponible
en ce qui concerne les solutions concentrées de chlorure de potassium. Aucune étude animale n’a été
réalisée afin d’évaluer les conséquences néfastes directes ou indirectes en ce qui concerne la
grossesse, le développement embryonnaire/fœtal, la naissance et le développement post-natal.
Néanmoins, étant donné que le potassium et le chlorure sont des composants de tous les organismes
vivants, aucun effet nocif n’est à prévoir.
La prudence s’impose lors de la prescription à des femmes enceintes. Les produits ne peuvent être
utilisés qu’en cas de stricte nécessité et après une évaluation soigneuse des bénéfices attendus et des
risques possibles.
Page 3 of 8

Allaitement
Aucune donnée issue d’études systématiques relatives à l’utilisation de solutions concentrées de
chlorure de potassium chez des femmes qui allaitent n’est disponible.
La prudence s’impose lors de la prescription à des femmes qui allaitent.
4.7 Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
KCl 7,45 % B. Braun et KCl 14,9 % B. Braun n’ont aucun effet sur l’aptitude à conduire des
véhicules et à utiliser des machines.
4.8 Effets indésirables
Des effets indésirables sont à prévoir uniquement à la suite d’un surdosage absolu ou relatif et/ou
d’une vitesse de perfusion trop élevée. Ils se manifestent alors sous la forme des symptômes de
l’hyperkaliémie. Voir également la rubrique 4.9. La fréquence des effets indésirables dépend de la
dose.
•Troubles du métabolisme et de la nutrition
Acidose, hyperchlorémie
•Affections cardiaques
La perfusion trop rapide peut provoquer des troubles du rythme cardiaque.
•Affections gastro-intestinales
Nausées
•Troubles généraux et anomalies au site d’administration
Douleur au site d’administration
Phlébite
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante.
Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels
de la santé sont priés de déclarer tout effet indésirable suspecté via l’Agence fédérale des
médicaments et des produits de santé - site internet : www.afmps.be
4.9 Surdosage
Symptômes
Le surdosage peut provoquer une hyperkaliémie, principalement en cas d’acidose ou d’insuffisance
rénale.
Les symptômes de l’hyperkaliémie sont essentiellement des troubles cardiovasculaires. Ils peuvent se
manifester comme suit : bradycardie, bloc AV et fibrillation ventriculaire et arrêt cardiaque. À l’ECG,
des ondes T symétriques hautes et pointues sont observables ainsi que, en cas de kaliémie très élevée,
un élargissement du complexe QRS. Les effets vasculaires sont une hypotension et une centralisation.
Les symptômes neuromusculaires sont notamment les suivants : fatigue, faiblesse, confusion, lourdeur
des membres, tremblements musculaires, paresthésie et paralysie ascendante.
Des concentrations de potassium de 6,5 mmol/l ou plus dans le plasma sont dangereuses ; des
concentrations de plus de 8 mmol/l sont souvent mortelles.
Traitement d’urgence, antidote
La première mesure à prendre consiste à arrêter immédiatement la perfusion.
Page 4 of 8

En cas d’hyperkaliémie (arythmies cardiaques) avec toxicité cardiaque, arrêter le traitement et injecter
10 à 20 ml d’une solution de gluconate de calcium à 10 %, par voie intraveineuse lente (1 à
5 minutes). Cette administration doit s’accompagner d’un contrôle par ECG. Une solution de 25 % de
glucose + 10 unités d’insuline par 20 g de glucose peut également être perfusée à raison de 300 à
500 ml/h.
Si nécessaire, l’hyperkaliémie peut être traitée par hémodialyse ou dialyse péritonéale.
La prudence s’impose chez les patients sous traitement digitalique, chez qui une baisse trop rapide de
la kaliémie peut accélérer la toxicité cardiaque.
5. PROPRIÉTÉS PHARMACOLOGIQUES
5.1 Propriétés pharmacodynamiques
Classe pharmacothérapeutique : additifs pour solutions intraveineuses – solutions électrolytiques
Code ATC : B05X A01
L’effet thérapeutique des solutions concentrées de chlorure de potassium pour administration
intraveineuse est la prévention ou la correction d’un déficit potassique lorsqu’une administration
orale (ou entérale) est impossible ou inadéquate.
Les besoins quotidiens en potassium sont d’environ 1 à 1,5 mmol par kilogramme de poids corporel.
Le déficit potassique peut être dû à une excrétion rénale accrue, une perte gastro-intestinale accrue
(vomissements ou diarrhée, par exemple), des fistules, une assimilation intracellulaire accrue (lors
du traitement d’une acidose ou d’un traitement par glucose et insuline) ou une prise de potassium
insuffisante.
L’hypokaliémie s’accompagne d’une faiblesse musculaire, d’une atonie des muscles lisses du
tractus gastro-intestinal (allant d’une constipation à un iléus paralytique), d’une perte de la
capacité des reins à concentrer l’urine, de modifications de l’ECG et d’une arythmie cardiaque.
Le potassium est le principal cation de l’espace intracellulaire. Environ 98 % du potassium de
l’organisme s’y trouvent.
Le potassium participe aux processus électrochimiques des cellules ainsi qu’au métabolisme des
glucides et des protéines. Il est absorbé dans les cellules lors de la synthèse du glycogène et est
libéré lors de la dégradation de ces substrats (env. 0,4-1 mmol potassium/g glycogène et env. 2-
3 mmol potassium/g azote perdu).
5.2 Propriétés pharmacocinétiques
Absorption
Biodisponibilité:
Si le produit est administré en intraveineuse, la biodisponibilité est de 100 %.
Distribution
La distribution du potassium suit les routes physiologiques normales du métabolisme du potassium.
La concentration de potassium dans le plasma dépend étroitement de l’équilibre acido-basique.
L’alcalose s’accompagne souvent d’une hypokaliémie et l’acidose d’une hyperkaliémie. Une
concentration normale de potassium dans le plasma en présence d’une acidose indique un déficit
potassique.
La concentration intracellulaire de potassium est d’environ 140-150 mmol/l. La concentration
normale de potassium dans le plasma se situe entre 3,5 et 5 mmol/l.
Le chlorure est présent partout dans l’organisme. Les concentrations de chlorure varient selon le
type de cellule et le compartiment liquidien. La concentration de chlorure extracellulaire est
Page 5 of 8
 6
6
 7
7
 8
8
1
/
8
100%