Intérêt clinique de l`étude de la cristallurie

Intérêt clinique de l’étude de la cristallurie
M. Daudon
1
P. Jungers
2
B. Lacour
1
1
Laboratoire de biochimie A,
2
Département de néphrologie,
Groupe hospitalier Necker-enfants
malades, Paris
Article reçu le 4 février 2004,
accepté le 29 mars 2004
Tirés à part : M. Daudon
Résumé. La cristallurie est un marqueur de la sursaturation des urines qui
s’observe en urines normales ou pathologiques. Cependant, la nature et les
caractéristiques de la cristallurie sont souvent révélatrices d’anomalies biochi-
miques ou de pathologies qui peuvent être aisément dépistées ou surveillées
par son analyse. Matériel et méthode. En pratique clinique, l’examen de la
cristallurie peut être réalisé par microscopie optique à polarisation en cellule de
type Malassez sur la première urine du réveil ou une urine fraîchement émise à
jeun. Le prélèvement doit être conservé à 37 °C ou à température ambiante et
examiné dans les deux heures pour avoir toute sa signification clinique. Résul-
tats et discussion. La cristallurie s’interprète en fonction de différents critères
qui sont : 1) la nature chimique pour les espèces particulières comme par
exemple la struvite, l’urate d’ammonium, la cystine, la dihydroxyadénine, la
xanthine ou les médicaments ; 2) la nature cristalline pour les espèces couran-
tes comme les oxalates de calcium, les phosphates de calcium ou les acides
uriques ; 3) la forme des cristaux (oxalates de calcium) ; 4) leur taille (oxalates
de calcium) ; 5) leur abondance (oxalates de calcium, phosphates de calcium,
acides uriques, cystine) ; 6) leur agrégation (oxalates de calcium) ; 7) leur
fréquence, jugée sur des prélèvements sériés qui trouvent leur intérêt dans le
suivi clinique des patients. Parmi les oxalates de calcium, la whewellite est un
marqueur des hyperoxaluries (oxalate > 0,3 mmol/L) ; son abondance oriente
vers des hyperoxaluries majeures d’origine génétique ou absorptive (nombre
de cristaux > 200/mm
3
). La weddellite est généralement un simple marqueur
d’hypercalciurie de concentration (calciurie > 3,8 mmol/L), mais la forme des
cristaux (faciès dodécaédrique) oriente vers des hypercalciuries majeures
(calciurie > 6 mmol/L) alors que leur taille élevée (≥35 µm) traduit en plus
l’existence d’une hyperoxalurie. Le calcul du volume cristallin global appliqué
à l’oxalate de calcium ou à la cystine est un outil de surveillance clinique très
utile pour la prise en charge des hyperoxaluries primaires et des cystinuries.
Enfin, une fréquence de cristallurie supérieure à 50 % sur une série d’urines du
réveil est, chez tout lithiasique, le marqueur d’un risque élevé de récidive de la
maladie lithiasique. Conclusion. L’étude de la cristallurie est un examen indis-
pensable dans le dépistage et le suivi des pathologies à fort pouvoir cristallo-
gène génératrices de lithiase ou d’altération de la fonction rénale.
Mots clés : cristallurie, volume cristallin, calcul urinaire, oxalate de
calcium, cystine
Summary. Crystalluria is a marker of urine supersaturation present in both
normal and pathological conditions. Indeed, nature and characteristics of the
spontaneous crystalluria are of clinical interest for detecting and following
biological disorders involved in renal diseases. Method. Crystalluria examina-
tion should preferably be performed on first morning urine or fresh fasting
voiding samples by polarised microscopy in a Malassez cell. Urine samples
must be stored at 37°C or at room temperature and examined within two hours
following voiding. Results and discussion. Crystalluria should be interpreted
according to various criteria: 1) chemical nature of crystals for abnormal crys-
tals such as struvite, ammonium urate, cystine, dihydroxyadenine, xanthine or
drugs; 2) crystalline phase of common chemical species as calcium oxalates,
revue générale abc
Ann Biol Clin 2004, 62 : 379-93
Ann Biol Clin, vol. 62, n° 4, juillet-août 2004 379
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 04/06/2017.

calcium phosphates and uric acids; 3) crystal morphology (calcium oxalates);
4) crystal size (calcium oxalates); 5) crystal abundance (calcium oxalates,
calcium phosphates, uric acids, cystine); 6) crystal aggregation (calcium oxala-
tes); 7) frequency of crystalluria assessed on serial first morning urine samples,
a very useful tool for long-term surveillance of patients. Within calcium oxa-
late crystalluria, presence of whewellite is a marker of elevated oxalate concen-
tration (urine oxalate > 0.3 mmol/L); a crystal number > 200/mm
3
is highly
suggestive of heavy hyperoxaluria of genetic or absorptive origin. Predominant
weddellite crystalluria is most often indicative of an excessive urine calcium
concentration (> 3.8 mmol/L); a dodecahedric aspect of the crystals is a marker
for heavy hypercalciuria (> 6 mmol/L) while an increased crystal size (≥35 µm)
is indicative of simultaneous hypercalciuria and hyperoxaluria. Calculation of
the global crystal volume, especially when applied to calcium oxalates or
cystine, is a clinically useful tool for the monitoring of patients suffering from
primary hyperoxaluria or cystinuria. Lastly, presence of crystalluria in more
than 50% of serial first voided morning urine samples is in our experience the
most reliable biological marker for detecting the risk of stone recurrence in
lithiasic patients. Conclusion. Crystalluria examination is an essential labora-
tory test for detecting and following pathological conditions, which may in-
duce renal stone disease or alter kidney function due to urine crystals.
Key words: crystalluria, crystal volume, urolithiasis, calcium oxalate, cystine
Les urines représentent un milieu sursaturé en permanence
vis-à-vis d’une ou de plusieurs espèces cristallines. En
première analyse, il n’est donc pas anormal qu’elles puis-
sent contenir des cristaux, si bien que l’étude de la cristal-
lurie est considérée par certains auteurs comme un exa-
men sans intérêt clinique [1]. En réalité, la cristallurie
traduit une rupture d’équilibre entre deux catégories de
substances, d’une part les promoteurs et, d’autre part, les
inhibiteurs de la cristallisation. Les premiers représentent
le moteur de la formation des cristaux : ce sont les subs-
tances dont la concentration urinaire excessive, c’est-à-
dire supérieure à leur produit de solubilité dans l’urine, les
conduit à cristalliser. Les seconds sont constitués de subs-
tances de faible ou de haut poids moléculaire dont les
propriétés physico-chimiques permettent de s’opposer à
une ou plusieurs étapes du processus de cristallisation. La
rupture d’équilibre peut être due à un excès de concentra-
tion des promoteurs, à un défaut de concentration des
inhibiteurs ou encore à une altération de leur structure
moléculaire [2]. Une modification de l’état d’ionisation,
tant des promoteurs que des inhibiteurs, en particulier sous
l’influence du pH des urines, joue également un rôle essen-
tiel dans la rupture d’équilibre, de même que dans sa
restauration, ce qui est à la base du traitement médical de
plusieurs pathologies lithiasiques. Enfin, comme l’ont bien
montré certains auteurs, les caractéristiques de la cristallu-
rie peuvent être différentes chez les sujets à risque de faire
des calculs comparativement aux sujets témoins [3, 4].
Considérée sous ses différents aspects, la cristallurie appa-
raît donc comme un phénomène complexe dont la variabi-
lité et les caractéristiques peuvent justifier une étude aux
retombées cliniques particulièrement utiles en termes de
diagnostic étiologique et de prise en charge des patients.
Choix du prélèvement
L’étude de la cristallurie spontanée ne peut se faire, pour
être cliniquement significative, que sur des urines fraîche-
ment émises : premières urines du réveil, particulièrement
intéressantes chez les patients lithiasiques parce qu’elles
sont souvent les plus concentrées, ou urines fraîches émi-
ses à jeun au laboratoire. Dans tous les cas, il est impor-
tant que l’urine soit recueillie directement dans le flacon
qui sera analysé pour éviter la perte de cristaux par trans-
vasement et que l’analyse soit réalisée dans le minimum
de temps.
En effet, en raison de la sursaturation des urines qui favo-
rise leur cristallisation in vitro, l’examen doit être pratiqué
le plus rapidement possible, sachant que la nature et les
caractéristiques de la cristallurie ne sont pas uniquement
le reflet du déséquilibre promoteurs-inhibiteurs au niveau
rénal, mais également le reflet de ce déséquilibre au ni-
veau vésical, compte tenu du temps de séjour plus ou
moins prolongé des urines dans la vessie.
Dans l’idéal, les urines devraient être gardées à 37 °C
jusqu’à l’analyse [5]. En pratique, la conservation à tem-
revue générale
Ann Biol Clin, vol. 62, n° 4, juillet-août 2004380
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 04/06/2017.

pérature ambiante, plus aisée pour les patients comme
pour les laboratoires, n’altère pas significativement les ré-
sultats si le prélèvement n’est pas conservé durablement
au-dessous de 20 °C et si l’examen est réalisé dans les
deux heures [6]. En revanche, sauf cas particuliers, une
cristallurie n’a pas d’intérêt clinique lorsqu’elle est obser-
vée sur une urine conservée à + 4 °C, car la conservation
des urines au froid augmente considérablement la fré-
quence, le nombre et la taille des cristaux aussi bien chez
les patients lithiasiques que chez les témoins.
En pratique clinique courante, la cristallurie observée sur
des urines conservées à température ambiante pendant
moins de 2 heures est un excellent marqueur du risque
potentiel de lithogenèse et de récidive lithiasique [7].
Les techniques d’analyse
De nombreuses techniques d’analyse ont été publiées, re-
posant parfois sur l’utilisation d’équipements inaccessi-
bles en pratique clinique courante, comme le microscope
électronique à balayage [8] ou les compteurs de particules
[5]. Divers protocoles ont été appliqués à l’étude des cris-
talluries reposant sur la filtration des urines [5, 8, 9], leur
évaporation [10] ou leur centrifugation [9, 11]. Dans le
cadre de la recherche clinique, ces différentes techniques
ont apporté des informations très utiles sur la compréhen-
sion des phénomènes impliqués dans la formation des cris-
taux et des calculs et sur les caractéristiques physico-
chimiques des cristaux, ainsi que sur les différences entre
sujets normaux et lithiasiques. Cependant, nombre de ces
protocoles et méthodes sont inapplicables à la pratique
clinique en raison du coût des équipements nécessaires ou
de la complexité des procédures.
En routine, l’examen en microscopie optique, à condition
que le microscope soit équipé de la polarisation, est la
technique la plus aisée et la plus informative. Elle est
utilisable par tous les laboratoires qui pratiquent en rou-
tine l’examen microscopique des urines [11].
Protocole d’étude standard
Le prélèvement doit être traité dès réception au labora-
toire. La mesure du pH à 0,1 unité près, au pH-mètre ou à
l’aide de papiers indicateurs à double échelle colorée, de-
vrait être accompagnée, si l’examen concerne un patient
lithiasique, d’une mesure de la densité urinaire [12].
Celle-ci constitue un examen particulièrement utile pour
juger de la bonne répartition des apports hydriques chez
un patient lithiasique. En effet, un malade qui s’efforce,
sur les conseils de son médecin, d’avoir une diurèse quoti-
dienne d’au moins 2 litres par jour, et dont la densité des
urines du réveil est supérieure ou égale à 1 020, répartit
mal ses boissons sur le nycthémère et s’expose à la réci-
dive lithiasique pendant la nuit. Réalisée au moyen d’un
densimètre ou d’une bandelette réactive, cette détermina-
tion est donc très importante pour juger du degré de dilu-
tion des urines et peut constituer un moyen d’autosur-
veillance pour le patient entre deux analyses d’urines par
le laboratoire. Cela lui permet d’ajuster ses apports hydri-
ques sur la densité de ses urines et donc de mieux les
répartir, l’objectif étant d’avoir une densité urinaire infé-
rieure à 1 012 dans la journée et au moins inférieure à
1 015 sur l’urine du réveil. Toutefois, lorsque l’on utilise
une bandelette, la densité lue doit être corrigée en fonction
de la valeur du pH [13].
La seconde étape de l’analyse de la cristallurie est l’étude
microscopique qualitative et quantitative des éléments fi-
gurés et des cristaux. Étant donné que les urines normales
peuvent contenir des cristaux, souvent en faible propor-
tion, il est souhaitable de désensibiliser l’examen, ce qui
améliore sa spécificité. Pour cela, on examine l’urine après
homogénéisation par retournement et non après centrifu-
gation. La procédure la plus facilement applicable en rou-
tine consiste à examiner l’urine ainsi homogénéisée à
l’aide d’un microscope à polarisation après transfert à
l’aide d’une pipette dans une cellule de type Malassez ou
équivalent.
L’examen microscopique doit inclure une étude cytologi-
que comprenant une numération des érythrocytes, leuco-
cytes et cellules épithéliales. Doivent aussi être mention-
nées la présence, l’abondance (semi-quantitative) et la
nature des cylindres éventuels, ainsi que la présence de
mucus, de bactéries et de levures. L’étude des cristaux
comporte une recherche et une identification de toutes les
espèces cristallines présentes ; une numération et une dé-
termination des tailles moyenne et maximale des cristaux
par espèce (pour les granulations, une estimation semi-
quantitative est suffisante) ; enfin, une numération séparée
des agrégats (définis comme l’association d’au moins trois
cristaux), ainsi qu’une détermination de leurs tailles
moyenne et maximale. La numération des agrégats est
sans objet pour les espèces qui précipitent sous forme de
granulations. En revanche, elle est très importante pour les
espèces qui peuvent donner lieu à une estimation du vo-
lume cristallin global utilisé dans certaines indications cli-
niques.
Cas particuliers
Dans le cadre d’un diagnostic primitif d’anomalie généti-
que cristallogène (déficit en adénine phosphoribosyltrans-
férase ou cystinurie congénitale par exemple) ou d’une
recherche de cristallisation médicamenteuse à l’origine
d’une insuffisance rénale aiguë, on peut recourir à la cen-
trifugation de l’urine car, dans ces cas particuliers, la détec-
tion et l’identification des cristaux spécifiques sont plus
importantes que leur numération.
Cristallurie
Ann Biol Clin, vol. 62, n° 4, juillet-août 2004 381
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 04/06/2017.

Paramètres calculés
Une fois les paramètres de la cristallurie recueillis, il est
possible de calculer différents marqueurs du profil cristal-
logène qui ont un intérêt dans la surveillance clinique des
malades. Les deux principaux sont le taux d’agrégation
(nombre d’agrégats × 100)/(nombre de cristaux isolés +
nombre d’agrégats) et le volume cristallin global (VCG).
Le premier permet de juger des potentialités anti-
agrégantes des urines, qui sont parfois fortement déficien-
tes chez certains malades lithiasiques [12, 14]. Le second
paramètre a prouvé son intérêt dans la prise en charge
médicale des malades atteints d’hyperoxalurie primaire
[15] et dans la cystinurie congénitale [16]. Le VCG peut
être estimé à partir de l’examen microscopique des cris-
taux sur un prélèvement homogénéisé et déposé en cellule
de Malassez. Pour les laboratoires qui disposent de l’équi-
pement nécessaire, il peut aussi être déterminé à l’aide de
compteurs de particules comme cela a été proposé dans
plusieurs études [5, 17].
Critères d’interprétation
de la cristallurie
De nombreux travaux ont montré que la cristallurie est
fréquente chez le sujet normal comme chez le patient li-
thiasique, même si sa fréquence et, souvent, son abon-
dance sont plus élevées chez ce dernier [8, 9, 11, 18].
L’interprétation clinique de la cristallurie doit intégrer dif-
férents critères qui peuvent ne s’appliquer qu’à certaines
espèces cristallines. Ces critères sont les suivants : nature
chimique des cristaux, nature cristalline, faciès cristallin,
abondance de la cristallurie, taille des cristaux, taux d’agré-
gation, fréquence de la cristallurie.
L’utilisation de ces critères implique au préalable une re-
connaissance des cristaux observés selon leurs caractéris-
tiques morphologiques et leur aspect en lumière polarisée,
sachant que le pH de l’urine doit aussi être considéré. Les
planches de cristaux jointes en Annexe (pages 389 à 392)
aideront à cette identification qui peut aussi s’appuyer sur
les photographies contenues dans différents ouvrages pu-
bliés antérieurement [11, 19, 20] ou des documents acces-
sibles sur le réseau internet [21].
Nature chimique
Au plan diagnostique, certains cristaux sont significatifs
du fait de leur simple présence, indépendamment de toute
autre considération qualitative ou quantitative. C’est le cas
des cristaux de :
– cystine, qui révèlent une cystinurie congénitale par ano-
malie du transporteur rénal BAT (broad-scope aminoacid
transporter) assurant la réabsorption tubulaire proximale
de la cystine et des aminoacides dibasiques. La maladie
résulte soit d’une mutation du gène SLC3A1 localisé sur
le chromosome 2, qui code pour une sous-unité (rBAT) du
transporteur, soit d’une mutation du gène SLC7A9 sur le
chromosome 19 codant pour BAT. Certains patients peu-
vent être hétérozygotes doubles par mutation simultanée
des deux gènes. Ils développent alors une lithiase cystini-
que comme les sujets homozygotes pour chaque muta-
tion ;
– dihydroxyadénine, qui résultent d’un déficit homo-
zygote, plus rarement hétérozygote en adénine phosphori-
bosyltransférase par mutation du gène APRT localisé sur
le chromosome 16 ;
– sels de l’acide orotique, qui s’observent dans les rares
déficits en orotate phosphoribosyltransférase et orotidylate
décarboxylase ;
– xanthine, que l’on peut observer dans les déficits homo-
zygotes en xanthine déshydrogénase ou au cours du traite-
ment des syndromes de Lesch-Nyhan par des doses exces-
sives d’allopurinol ;
– leucine, qui peuvent être rencontrés dans les leucinoses
et la maladie de Hartnup ;
– tyrosine, qui peuvent accompagner une tyrosinose ou
certaines pathologies hépatiques graves ;
– struvite, qui résultent de l’uréolyse observée dans les
infections urinaires par des micro-organismes possesseurs
d’une uréase dont certains, comme Ureaplasma urealyti-
cum ou Corynebacterium urealyticum, restent souvent mé-
connus faute d’avoir utilisé des conditions de culture ap-
propriées. Il est utile de se rappeler que la simple présence
de cristaux de struvite associée à un pH élevé des urines
représente un critère suffisant pour affirmer l’existence
d’une infection par un micro-organisme uréasique. D’un
point de vue clinique, le caractère uréasique d’un germe
isolé des urines devrait être systématiquement précisé sur
le compte rendu bactériologique étant donné l’implication
particulière de ces germes dans les lithiases urinaires d’ori-
gine infectieuse et le développement de pyélonéphrites
chroniques pouvant conduire à l’insuffisance rénale ;
– urate d’ammonium, qui traduisent une hyperuricurie as-
sociée à une hyperammoniurie et qui, selon le pH de
l’urine, orientent soit vers une infection urinaire à germes
uréasiques soit vers des diarrhées infectieuses avec perte
digestive de bases et d’électrolytes chez des sujets ayant
des apports insuffisants en phosphore ;
– médicaments, qui compliquent un traitement aigu ou
chronique à une posologie mal adaptée sans mesures de
prévention du risque cristallogène.
Pour toutes ces espèces, la simple présence de cristaux
doit faire rechercher la cause évoquée. Dans le cadre de la
prise en charge thérapeutique d’une maladie clairement
identifiée, la présence des cristaux traduit une correction
imparfaite du risque cristallogène, mais d’autres critères
doivent alors être pris en compte pour juger, par exemple,
revue générale
Ann Biol Clin, vol. 62, n° 4, juillet-août 2004382
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 04/06/2017.

du risque de récidive lithiasique. Les principales caracté-
ristiques des cristalluries et leur signification pathologique
sont résumées dans le tableau I.
Nature cristalline
Ce critère doit être considéré pour les espèces chimiques
usuelles capables de cristalliser fréquemment dans les uri-
nes, c’est-à-dire essentiellement l’oxalate de calcium, le
phosphate de calcium et l’acide urique. Différentes espè-
ces cristallines sont connues dans les urines humaines pour
chacune de ces substances. L’oxalate de calcium peut cris-
talliser sous forme monohydratée (whewellite ou Wh), di-
hydratée (weddellite ou Wd) ou trihydratée (calcium oxa-
late trihydrate des Anglo-Saxons ou COT). Le phosphate
de calcium peut se présenter sous forme de phosphate
acide de calcium dihydraté (brushite ou Br) ou d’ortho-
phosphates calciques, carbonatés ou non, comme la carba-
patite (phosphate de calcium carbonaté de formule non
stœchiométrique, cristallisé dans le système hexagonal), le
phosphate amorphe de calcium carbonaté, le phosphate
octocalcique pentahydraté et la whitlockite (phosphate
mixte de calcium et magnésium hydraté). L’acide urique
précipite principalement sous forme d’acide urique dihy-
draté ou anhydre et sous la forme d’urates amorphes com-
plexes, qui sont en réalité une forme amorphe de l’acide
urique contenant de faibles proportions de divers cations
comme le sodium, l’ammonium, le potassium, le calcium
ou le magnésium dans un rapport non stœchiométrique.
Les urates amorphes complexes évoluent spontanément
avec le temps vers l’acide urique dihydraté. Une qua-
trième forme, monohydratée, de l’acide urique est beau-
coup plus rare.
Oxalates de calcium
Comme le montre la figure 1, le moteur de la cristallisa-
tion de l’oxalate de calcium est le produit molaire oxalo-
calcique, mais la forme cristalline sous laquelle on l’ob-
serve dans les urines est fortement dépendante du rapport
molaire calcium/oxalate. La whewellite, cristallisée sous
forme de cristaux ovales à centre déprimé ou en haltères
est oxalo-dépendante et se forme dans des urines où la
concentration en oxalate est élevée (supérieure à
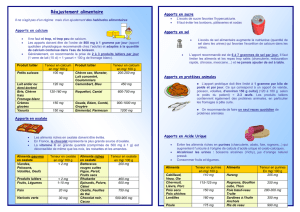
Tableau I. Principales caractéristiques de la cristallurie et orientations étiologiques correspondantes.
Nature des cristaux Caractéristiques de la cristallurie Pathologie ou anomalie associée
Weddellite Présence Peu significative, sauf chez le lithiasique :
hypercalciurie de concentration (> 3,8 mmol/L)
Faciès dodécaédrique des cristaux Hypercalciurie majeure
Taille des cristaux > 35 µm Hypercalciurie + hyperoxalurie ± hypocitraturie
Risque majeur de lithiase
Whewellite Présence Hyperoxalurie de débit ou de concentration
Nombre de cristaux > 200/mm
3
Hyperoxalurie massive
Faciès des cristaux en navettes
et hexagones étirés
Intoxication à l’éthylène-glycol
Volume cristallin V
CaOx
> 1 000 µm
3
/mm
3
Chez le transplanté rénal, risque d’altération du greffon
par cristallisation intratubulaire
Brushite Présence Hypercalciurie + hyperphosphaturie ± hypocitraturie
Nombre de cristaux > 500/mm
3
Hyperparathyroïdie primaire
Nucléation hétérogène avec la weddellite Risque majeur de lithiase calcique
Orthophosphates calciques
(PACC, carbapatites,
phosphate octocalcique{)
Présence Pas de signification clinique
Précipitation abondante Acidose tubulaire, traitement alcalinisant, infection urinaire
Cylindres granulaires Acidose tubulaire, traitement alcalinisant
Struvite Présence Infection à germes uréasiques
Urate acide d’ammonium Si pH > 7,0 Hyperuricurie + infection à germes uréasiques ou ammoniogènes
Si pH < 7,0 Hyperuricurie + diarrhées chroniques + carence phosphorée,
maladie des laxatifs
Acide urique dihydraté ou anhydre Si pH ≤5,3 Risque de lithiase urique par hyperacidité urinaire,
syndrome polymétabolique
Si pH > 5,3 Hyperuricurie
Urates amorphes complexes Précipitation abondante (urine fraîche) Hyperuricurie (d’autant plus importante que le pH est plus élevé)
Cystine Présence Cystinurie
Volume cristallin V
Cys
> 3 000 µm
3
/mm
3
Risque majeur de récidive lithiasique
2,8-dihydroxyadénine Présence Déficit en adénine phosphoribosyltransférase
Médicaments Cristaux en aiguilles, en baguettes ou en lamelles
agrégées de grandes dimensions (> 50 µm)
Risque d’insuffisance rénale aiguë ou de lithiase
Cristallurie
Ann Biol Clin, vol. 62, n° 4, juillet-août 2004 383
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 04/06/2017.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%