L`ablation par radiofréquence dans le traitement du cancer du rein

L'Office canadien de coordination de l’évaluation des technologies de la santé (OCCETS)
est financé par les gouvernements fédéral, provinciaux et territoriaux canadiens. (www.ccohta.ca)
Sommaire
Le traitement habituel du cancer du rein con-
siste en une néphrectomie radicale ou par-
tielle (ablation du rein).
L’ablation par radiofréquence (ARF), inter-
vention moins effractive, représente une
option dans le traitement des petites tumeurs
et dans les cas où la chirurgie est contre
indiquée.
Son innocuité et son efficacité se comparent
avantageusement à celles d’autres interven-
tions.
La persistance de tumeurs résiduelles représen-
tait un inconvénient des versions précédentes
de cette technologie. L’utilisation de généra-
teurs de radiofréquence (RF) plus puissants
pourrait réduire une telle persistance, mais les
preuves définitives à cet effet ne sont pas
disponibles.
L’expérience de l’application de cette techno-
logie demeure limitée. Un suivi de plus longue
durée des patients sera nécessaire afin de
fournir une comparaison appropriée avec la
néphrectomie.
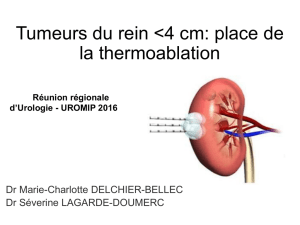
La technologie
Chaque année, environ 4 500 Canadiens reçoivent un
diagnostic de cancer du rein et environ 1 500 d’entre
eux en meurent1. La forme la plus fréquente de can-
cer du rein est l’hypernéphrome, lequel représente
environ 90 % de tous les cas2.
L’ablation par radiofréquence (ARF) est l’une des
quelques interventions les moins effractives ayant fait
l’objet de recherches dans le traitement du cancer du
rein. Dans cette technique, une électrode génératrice
de courants électriques de radiofréquence (RF) trans-
met de l’énergie dans la tumeur visée. L’impédance
tissulaire entraîne la génération de chaleur, l’atteinte
de températures létales, puis l’ablation des tissus3.
Cette intervention réalisée sous anesthésie ambula-
toire s’effectue par voie percutanée, sous contrôle
tomodensitométrique ou échographique. On utilise la
laparoscopie pour éradiquer les tumeurs antérieures
et celles qui se situent près d’autres organes. Dans le
cas des tumeurs qui dépassent les 3 à 4 cm de
diamètre, il faut parfois plus d’une séance de traite-
ment pour les détruire.
Stade de la réglementation
Santé Canada a homologué plusieurs systèmes ser-
vant à la coagulation et à l’ablation des lésions des
tissus mous par RF. Il s’agit des générateurs de
radiofréquence RF 2000TM et RF 3000®, fabriqués par
la Boston Scientific Corporation (de San Jose, en
Californie), du système d’ablation par radiofréquence
CooltipTM de ValleylabTM (de Boulder, au Colorado) et
du générateur de radiofréquence RITA®de RITA
Medical Systems, Inc. (de Fremont, en Californie)4,5.
Ces systèmes peuvent être utilisés avec diverses élec-
trodes. Aux États Unis, les systèmes par radio-
fréquence ont reçu l’approbation à l’avis 510(k) de la
Food and Drug Administration pour l’ablation des
tissus mous et sont utilisés dans le traitement d’autres
organes, notamment dans les cas de cancers du foie
et du poumon6.
Groupe cible
Jusqu’à maintenant, l’ARF a été utilisée le plus sou-
vent chez des adultes atteints de petites tumeurs
rénales. Parmi les indications de cette technique, on
compte les affections concomitantes qui empêchent
le recours à la chirurgie, de même que les cas où les
patients n’ont qu’un seul rein ou sont atteints d’un
hypernéphrome à foyers multiples. D’abord expéri-
mentée chez les patients sans métastases, l’ARF a
ensuite été utilisée chez les patients présentant un
nombre limité de métastases et une lente évolution
documentée de la maladie7.
Pratique courante
Le traitement habituel de l’hypernéphrome nécessite
le recours à la chirurgie. La néphrectomie radicale
Notes sur les technologies de la santé en émergence
numéro 80
février 2006
L’ablation par radiofréquence dans le
traitement du cancer du rein

L’Office canadien de coordination de l’évaluation des technologies de la santé (OCCETS)
est financé par les gouvernements fédéral, provinciaux et territoriaux canadiens. (www.ccohta.ca)
par laparoscopie est une intervention établie dans la
prise en charge des patients atteints de tumeurs local-
isées, tandis que la néphrectomie partielle par laparo-
scopie est une technique en émergence comme
moyen de conserver le néphron8.
Données probantes
Plusieurs études, dont quelques récents exemples
apparaissent au tableau 1, prouvent les bienfaits de
l’ablation par radiofréquence. En effet, plusieurs
groupes ont montré des taux de réussite élevés lors
de l’ablation de petites tumeurs, surtout lorsque ces
dernières ne sont pas situées au centre du rein
(tumeurs exophytiques ou parenchymateuses). Dans
l’étude réalisée par Gervais et ses collaborateurs7, une
analyse multivariable a permis d’obtenir des résultats
qui correspondaient à ceux d’autres chercheurs. Ces
résultats montrent que les tumeurs de petite taille et
le fait qu’elles ne soient pas situées au centre d’un
organe constituent des paramètres de prédiction de
réussite. Une analyse de leurs résultats révèle que l’u-
tilisation de tumeurs ayant un diamètre de 4,2 cm ou
de 5,8 cm à titre de critères d’exclusion pourrait per-
mettre d’inclure 90 % ou 99 % respectivement de
toutes les tumeurs pour lesquelles une nécrose com-
plète peut être obtenue.
Tableau 1 : Résultats d’études sur l’ARF de tumeurs du rein
Étude Nombre de
patients et de
tumeurs
Taille
moyenne de
la tumeur
Localisation
exophytique ou
parenchymateuse
Taux de
réussite*
Durée moyenne
du suivi
Gervais7
(2005)
85 patients;
100 tumeurs
3,2 cm 68 % < 3 cm : 52 sur
52 ou 100 %; de
3 à 5 cm : 36 sur
39 ou 92 %;
> 5 cm : 2 sur 8
ou 25 %
28 mois
Matsumoto9
(2005)
91 patients;
109 tumeurs
2,4 cm 58 % 107 sur 109 ou
98 % après
6 semaines; 35
sur 36 ou 97 %
après 19,4 mois
Tous les patients
ont été suivis
pendant plus de
6 mois et 60
d’entre eux ont été
suivis pendant plus
de 12 mois
Veltri10 (2004) 13 patients;
18 tumeurs
2,4 cm pour
17 tumeurs;
1 tumeur de
7,5 cm
89 % 85 % 12 mois
Zagoria11
(2004)
22 patients;
24 tumeurs
3,5 cm 38 % 100 % 7 mois
Hwang12
(2004)
17 patients;
24 tumeurs
(8 interventions par
voie percutanée,
9 interventions par
laparascopie)
2,2 cm 42 % 23 sur 24 ou
96 %
13 mois
Farrel13 (2003) 20 patients;
35 tumeurs
(2 traitées en
période
intraopératoire)
1,7 cm 63 % 100 % 9 mois
Mayo-Smith14
(2003)
32 patients;
32 tumeurs
2,6 cm 91 % 100 % 9 mois
Su15 (2003) 29 patients;
25 tumeurs
2,2 cm 80 % 100 % 9 mois
* D’après les résultats obtenus lors de suivis tomodensitométriques.

L’Office canadien de coordination de l’évaluation des technologies de la santé (OCCETS)
est financé par les gouvernements fédéral, provinciaux et territoriaux canadiens. (www.ccohta.ca)
On a signalé une destruction incomplète des tumeurs
chez certains patients d’une étude. Rendon et ses col-
laborateurs16 ont traité quatre patients après une expo-
sition chirurgicale de la tumeur suivie
immédiatement d’une néphrectomie; puis, six
patients ont subi une ablation par voie percutanée
suivie d’une néphrectomie sept jours plus tard.
L’examen pathologique a montré la présence de cel-
lules tumorales résiduelles viables au sein de 5 % du
volume de quatre des cinq tumeurs du premier
groupe, et de trois des six tumeurs du groupe traité
plus tard. Dans une étude menée par Michaels et ses
collaborateurs17,15 patients ont subi une ARF avant
une néphrectomie partielle. L’examen pathologique
des 20 tumeurs réséquées a montré la présence de
cellules tumorales viables. Chez un groupe de huit
patients traités avant une chirurgie effractive, on a
noté la nécrose de sept des huit tumeurs. L’étendue
de la nécrose variait entre 15 et 90 % (moyenne de
60 %)18.
Lors de ces études, des générateurs de faibles
courants électriques de radiofréquence étaient utilisés
(50 watts, 90 watts et 150 watts)16-18. Hwang et ses
collaborateurs ont laissé entendre que l’utilisation de
générateurs de courants plus forts pourrait entraîner
une déposition d’énergie plus uniforme et un taux
plus élevé de mort cellulaire12. Au cours de leur
étude, 23 des 24 tumeurs réséquées à l’aide d’un
générateur de 200 watts ne présentaient pas de prise
de contraste à la tomodensitométrie après une période
de suivi minimal de deux ans. Les résultats pouvaient
laisser croire à une amélioration de l’efficacité, sans
être définitifs en raison de l’absence de preuves
histopathologiques. Gervais et ses collaborateurs ont
observé qu’un cas de leur étude illustrait les limites
des techniques d’imagerie dans la détection des
tumeurs résiduelles. L’évolution localisée du cancer
après l’ablation de la tumeur a été liée à la présence
de tissus malins résiduels qui n’avaient pu être dif-
férenciés d’un artéfact lors de la tomodensitométrie7.
Effets indésirables
Les complications associées à l’ARF et à la cryoabla-
tion ont été évaluées par Johnson et ses collabora-
teurs dans le cadre d’une étude multicentrique qui
regroupait 271 cas (133 ARF et 139 cryoablations)19.
Des 30 complications étudiées (11 liées à l’ARF), 26
étaient attribuables à la technique employée. Par
ailleurs, cinq complications étaient considérées
comme importantes. Trois d’entre elles sont surv-
enues après l’ARF, soit une occlusion intestinale, une
obstruction formée par le tissu cicatriciel résultant de
la lésion tissulaire et une fuite urinaire. Les auteurs
ont comparé leurs résultats à ceux d’études
antérieures sur des biopsies rénales réalisées par voie
percutanée et des laparoscopies urologiques. Ils ont
conclu que les techniques d’ablation sur le rein
entraînaient peu de complications lorsqu’elles ser-
vaient à traiter de petites tumeurs rénales. En effet, le
taux de complications était comparable à celui
d’autres interventions par laparoscopie et par voie
percutanée. À cet effet, parmi les 85 patients étudiés
par Gervais et ses collaborateurs7, l’hémorragie était
la complication la plus fréquente. Deux patients ont
dû recevoir une transfusion sanguine et deux patients
ont souffert de douleurs neuropathiques. Des cas
uniques de constriction urétérale, de miction
impérieuse, de brûlures et de masse asymptomatique
non cancéreuse à la paroi abdominale ont également
été signalés.
Coût
Le coût d’un générateur de radiofréquence varie entre
20 000 et 30 000 $CAN et les électrodes à usage
unique jetables coûtent généralement entre 600 et
1 000 $CAN4.
Selon Lotan et Cadeddu, le coût d’une intervention
utilisant l’ARF dans un établissement de Dallas, au
Texas, est de 4 454 $US, ce qui est plus économique
que le coût d’une laparoscopie ou d’une néphrec-
tomie effractive (dont le coût est de 7 013 $US et de
7 767 $US, respectivement)7. En Ontario, le coût
approximatif d’une ablation hépatique par radio-
fréquence est de 1 554 $CAN. Le coût des honoraires
professionnels, des frais de radiologie et des fourni-
tures chirurgicales sont tous plus élevés dans l’étude
américaine, laquelle inclut certains éléments qui ne
font pas partie de l’estimation de l’Ontario4.
Activités dans le domaine
Des travaux ont été réalisés quant à l’application
d’ultrasons focalisés de haute intensité dans le traite-
ment des tumeurs rénales. Des analyses ont permis
de conclure qu’il s’agissait d’une technique promet-
teuse, mais qu’elle devait être considérée comme
expérimentale et réservée à certains patients dans le
cadre de solides études cliniques8,20. L’utilisation de la
radiochirurgie stéréotaxique a également fait l’objet
d’études21.
Taux d’utilisation
L’ARF est utilisée dans le traitement d’autres types
de cancer et d’autres affections. On peut s’attendre à

L’Office canadien de coordination de l’évaluation des technologies de la santé (OCCETS)
est financé par les gouvernements fédéral, provinciaux et territoriaux canadiens. (www.ccohta.ca)
ce que la disponibilité des équipements d’ARF aug-
mente. Il est possible que leur taux d’utilisation
dépende du perfectionnement de la technologie, des
données restreintes sur les résultats à plus long terme
chez les patients et du jugement des spécialistes sur
les bienfaits de cette approche comparativement à
ceux d’autres techniques peu effractives.
Questions d’implantation
L’ARF est une technique en émergence comme solu-
tion de rechange utile à la néphrectomie dans la prise
en charge de certains types de cancer du rein. Son
utilité semble plus marquée dans les cas de petites
tumeurs non centrales et dans les cas où la chirurgie
est contre indiquée. Plusieurs aspects doivent être
portés à l’attention des personnes qui se servent de
cette technique. Un de ses inconvénients est la possi-
bilité que les cancers résiduels ne soient pas détectés
par l’imagerie diagnostique lors du suivi. En outre,
on ne dispose d’aucun résultat provenant d’essais
randomisés, et la période de suivi chez les patients
ayant subi ce type d’intervention est courte. Seules
les évaluations menées lors de suivis de plus longue
durée (sur 5 à 10 ans) permettront de réaliser des
comparaisons pertinentes avec la néphrectomie radi-
cale et partielle3.
La normalisation de l’ARF risque de poser problème.
En effet, Veltri et ses collaborateurs ont observé que
ce type d’intervention avait été effectuée à l’aide de
divers systèmes et techniques d’ablation, lesquels
comportaient plusieurs modèles d’électrodes et utili-
saient des puissances et des durées différentes10.
Enfin, la mise en ouvre de cette technique dépendra
de deux facteurs importants, soit le fait que l’utilisa-
tion de cette technique nécessite une formation
appropriée et la prise en considération des bienfaits
connus, du coût et des inconvénients des solutions de
remplacement dans la prise en charge des tumeurs du
rein.
Références
1. Canadian Cancer Society, et al. Canadian cancer statistics
2005. Toronto: The Society; 2005. Available:
http://www.ncic.cancer.ca/vgn/images/portal/cit_86751114/
60/42/393678947ncic_2005stats_en.pdf.
2. American Cancer Society. What is kidney cancer (renal cell
carcinoma)? Atlanta: The Society; 2005. Available:
http://www.cancer.org/docroot/cri/content/cri_2_4_1x_what
_is_kidney_cancer_22.asp.
3. Johnson DB, et al. Expert Rev Anticancer Ther
2004;4(1):77-83.
4. Medical Advisory Secretariat, Ontario Ministry of Health
and Long-Term Care. Radio frequency ablation for primary
liver cancer: health technology scientific literature and pol-
icy review. Toronto: The Ministry; 2004. Available:
http://www.health.gov.on.ca/english/providers/program/mas
/tech/reviews/pdf/rev_rfa_060104.pdf.
5. Medical devices active license listing [database online].
Rev. 2006 Jan 17. Ottawa: Medical Devices Bureau,
Therapeutic Products Directorate, Health Canada; 2006.
Available: http://www.mdall.ca/.
6. Hines-Peralta A, et al. Clin Cancer Res 2004;10(18 Pt
2):6328S-34S.
7. Gervais DA, et al. AJR Am J Roentgenol 2005;185(1):64-71.
8. Abreu SC, et al. Curr Opin Urol 2003;13(6):439-44.
9. Matsumoto ED, et al. Urology 2005;65(5):877-81.
10. Veltri A, et al. Eur Radiol 2004;14(12):2303-10.
11. Zagoria RJ, et al. AJR Am J Roentgenol 2004;183(1):201-7.
12. Hwang JJ, et al. J Urol 2004;171(5):1814-8.
13. Farrell MA, et al. AJR Am J Roentgenol 2003;180(6):1509-
13.
14. Mayo-Smith WW, et al. AJR Am J Roentgenol
2003;180(6):1503-8.
15. Su LM, et al. Urology 2003;61(4 Suppl 1):26-33.
16. Rendon RA, et al. J Urol 2002;167(4):1587-92.
17. Michaels MJ, et al. J Urol 2002;168(6):2406-9.
18. Brausi M, et al. Eur Urol Suppl 2004;3(3):14-7.
19. Johnson DB, et al. J Urol 2004;172(3):874-7.
20. Häcker A, et al. Curr Opin Urol 2003;13(3):221-5.
21. Ponsky LE, et al. Urology 2003;61(3):498-501.
Citer comme suit : Hailey D. L’ablation par radiofréquence
dans le traitement du cancer du rein [Notes sur les technolo-
gies de la santé en émergence, numéro 80]. Ottawa : L’Office
canadien de coordination de l’évaluation des technologies de la
santé; 2006.
**********************
L'OCCETS apprécie les commentaires de ces examinateurs.
Examinateurs : Edward D. Matsumoto MD MEd, Université
McMaster, Hamilton ON; David Valenti BSc MDCM, Centre
universitaire de santé McGill, Montreal QC.
Ce rapport ainsi que la version anglaise de ce rapport intitulée
Radiofrequency Ablation in the Treatment of Kidney Cancer
sont affichés sur le site Web de l’OCCETS.
La production de ce rapport a été rendue possible par l’apport
financier de Santé Canada et des gouvernements d’Alberta, de
la Colombie-Britannique, du Manitoba, du Nouveau Brunswick,
de la Terre-Neuve-et-Labrador, des Territoires du Nord-Ouest,
de la Nouvelle-Écosse, du Nunavut, de l’Ontario, de la
Saskatchewan et du Yukon. L’Office canadien de coordination
de l’évaluation des technologies de la santé assume l’entière
responsabilité de la forme finale et du contenu de ce rapport.
Les opinions exprimées dans ce rapport ne représentent pas
forcément celles du Santé Canada ou de gouvernements
provinciaux ou territoriaux.
ISSN 1488-6332 (en ligne)
ISSN 1486-2972 (imprimée)
CONVENTION DE LA POSTE-PUBLICATIONS NO40026386
RETOURNER TOUTE CORRESPONDANCE NE POUVANT
ÊTRE LIVRÉE AU CANADA À
OFFICE CANADIEN DE COORDINATION DE L’ÉVALUATION
DES TECHNOLOGIES DE LA SANTÉ
600-865 AVENUE CARLING
OTTAWA ON K1S 5S8
1
/
4
100%