1ère S

Tale S
Chapitre n° 11
CONTRÔLE DE L’ÉVOLUTION DE SYTÈMES CHIMIQUES
Introduction :
Pour des raisons de coût de production, les chimistes de l’industrie cherchent à contrôler la vitesse et le rendement des
transformations chimiques. Pour cela, plusieurs méthodes sont disponibles :
•utiliser un catalyseur.
•choisir un réactif plus approprié ;
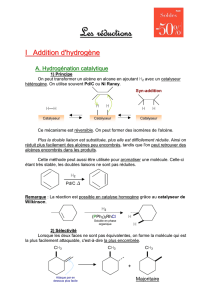
I- Utilisation d’un catalyseur d’un réactif
1°) La catalyse
a) Définition
La catalyse est le nom donné à l’action d’un catalyseur.
Un catalyseur est une espèce chimique qui permet d’augmenter la vitesse d’une réaction chimique mais qui ne
figure pas dans l’équation chimique puisqu’il n’est pas modifié au cours de la transformation.
b) Les différents types de catalyse •Une catalyse est dite homogène lorsque le catalyseur et les réactifs ne forment qu’une seule phase.
Ex. : la réaction de dismutation de l’eau oxygénée catalysée par les ions fer III.
•Une catalyse est dite hétérogène lorsque le catalyseur et les réactifs ne sont pas dans la même phase.
Ex. : la réaction de dismutation de l’eau oxygénée catalysée par un fil de platine.
•Une catalyse est dite enzymatique lorsque le catalyseur est une enzyme (catalyseur
synthétisé par les êtres vivants).
Ex. : la réaction de dismutation de l’eau oxygénée catalysée par le sang.
2°) Caractéristiques générales
a) Quantité utile d’un catalyseur
Un catalyseur est efficace même en faible quantité, puisqu’il est régénéré à la fin de son action.
b) Spécificité et sélectivité d’un catalyseur •Un catalyseur est spécifique d’une réaction ; il ne peut accélérer n’importe quelle réaction chimique. Il
participe réellement à la réaction qu’il catalyse :
* dans le cas de la catalyse hétérogène, le catalyseur agit au niveau de la surface de contact entre la
phase dans laquelle il se trouve et celle où se trouvent les réactifs.
* dans le cas de la catalyse homogène, le catalyseur agit dans tout le milieu réactionnel.
•Par voie de conséquence, lorsqu’un mélange réactionnel est le siège de plusieurs réactions chimiques (en
général, une réaction utile (souhaitée) et une ou plusieurs réactions parasites (non désirées)), le choix du
catalyseur permet de privilégier telle ou telle réaction : on parle alors de sélectivité d’un catalyseur.
c) Réactions spontanées et non spontanées
Un catalyseur accélère uniquement les réactions spontanées lentes, mais ne peut accélérer des réactions non
spontanées.
d) Influence sur l’état d’équilibre
Lorsqu’une transformation conduit à un état d’équilibre, le catalyseur accélère de la même façon les réactions
directe et inverse : il ne modifie donc pas l’état d’équilibre du système.
- 1 -

II- Changement d’un réactif
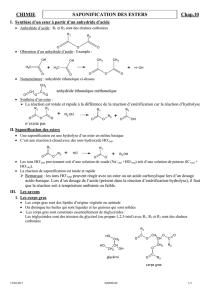
1°) Remplacement d’un acide carboxylique par un anhydride d’acide pour la réaction d’estérification
a) Formule •Un anhydride d’acide résulte de la jonction de deux acides carboxylique par élimination d’une molécule
d’eau :
•Le groupe fonctionnel d’un anhydride d’acide est :
b) Nomenclature
Le nom de l’anhydride d’acide reprend celui de l’acide carboxylique dont il provient, en remplaçant le mot
"acide" par "anhydride".
Ex. :
c) Utilisation pour la réaction d’estérification
Cette transformation totale et rapide a pour équation chimique :
Elle peut encore être accélérée en effectuant un chauffage modéré et en employant un catalyseur comme
l’acide sulfurique.
2°) Remplacement de l’eau par de la soude pour la réaction d’hydrolyse : la saponification
•La réaction de saponification est la réaction d’hydrolyse d’un ester effectuée à chaud et en milieu basique :
•Les ions carboxylate ne réagissant pas avec les molécules d’alcool, la réaction de saponification est
•La réaction de saponification est lente à température ambiante : cela permet, lors de l’étude de la réaction
d’estérification, de doser l’acide carboxylique restant avec de la soude, sans saponifier l’ester formé.
3°) Application à la fabrication des savons
a) Les corps gras
1 - Présentation •D’origine végétale ou animale, les corps gras, appelés encore lipides, sont essentiellement (98 %)
constitués de molécules appelées triglycérides.
•Ces molécules sont des triesters d’un alcool, le glycérol, et d’acides carboxyliques à longue chaîne
carbonée (de 4 à 22), les acides gras.
•Les corps gras comprennent les huiles et les graisses, qui, à température ambiante, sont respectivement
liquides et solides. Les premières contiennent essentiellement des acides gras saturés.
2 - Formule chimique •Le glycérol, ou propan-1,2,3-triol, a pour formule :
•L’estérification des trois groupes hydroxyle conduit à la formation d’un triester :
- 2 -
O O
CH3 CH2 C O C CH2 CH3
O O
CH3 C O C CH3
O O
CH3 C O C CH2 CH3
O O
C O C

Rq. : les groupes alkyles R1, R2 et R3 peuvent être identiques.
3 - Exemples d’acides gras •L’acide butanoïque (ou acide butyrique) est présent dans le beurre :
CH3 (CH2)2 COOH
•L’acide hexadécanoïque (ou acide palmitique) est présent dans l’huile de palme et le saint-doux :
CH3 (CH2)14 COOH
•L’acide (Z)-octadéc - 9 - ènoïque (ou acide oléique) est présent dans l’huile de palme, de soja, de colza,
d’olive :
CH3 (CH2)7 CH = CH (CH2)7 COOH
•L’acide (9-Z , 12 - Z) - octadéca - 9,12 - diènoïque (ou acide linoléique) est présent dans l’huile de
tournesol, de soja, de colza, de maïs :
CH3 (CH2) 4 (CH = CH CH2)2 (CH2) 6 COOH
b) Les savons
1 - Présentation •Un savon est un mélange de dérivés d’acides gras à longue chaîne carbonée : les carboxylates.
Les savons durs contiennent des carboxylates de sodium alors que les savons mous, des carboxylates de
potassium.
Ex. : Le palmitate de sodium : ( CH3 (CH2)14 COO- ; Na+ )
•L’ion carboxylate comporte deux parties distinctes :
oune longue chaîne carbonée constituant un pôle , et donc
o- un groupe carboxylate COO- constituant un pôle , et donc
•Les ions carboxylate sont des espèces , du fait de cette double affinité. On dit
aussi qu’il s’agit d’un
2 - Solubilité d’un savon dans l’eau distillée •Les savons sont solubles dans l’eau distillée, grâce à la présence du groupe polaire carboxylate. Des
liaisons hydrogène ( - - - )se forment entre les doublets non liants des atomes d’oxygène de l’ion
carboxylate et les atomes d’hydrogène du solvant, malgré le caractère hydrophobe de la chaîne carbonée.
•Application : le lavage
Les savons, de par leur double affinité peuvent ainsi se lier au solvant, l’eau, et aux graisses
indésirables que l’on souhaite enlever sur un vêtement ou les mains.
- 3 -
H O O H
H H
O
H
C H O
O -
H
O H O
H H
H

3 - Solubilité d’un savon en présence d’ions sodium •La solubilité d’un savon est plus faible en présence d’ions sodium.
•La dissolution d’un savon dans l’eau s’effectue selon l’équation chimique :
R - COONa (s)
dissolution
précipitation
→
←
R - COO- + Na+Qr,éq =
Rq. : Dans le cas d’une réaction de dissolution, Qr,éq est appelée constante de solubilité et notée Ks.
•Selon le critère d’évolution spontanée, l’ajout d’ions sodium va modifier l’équilibre entre ces ions et les
ions carboxylate en faveur de la précipitation du savon :
4 - Solubilité d’un savon en présence d’ions calcium et magnésium (dans l’eau dure) •Une eau est dite dure, si elle est riche en
•La solubilité d’un savon est plus faible en présence d’ions calcium et magnésium. En effet, ces ions
précipitent avec les ions carboxylate du savon : les carboxylate de calcium et de magnésium sont des
composés insolubles dans l’eau.
En présence d’ions calcium et magnésium, un savon ne peut donc rester dissous.
Rq. : Dans une eau dure, un savon commence à être efficace lorsque tous les ions calcium et magnésium
ont précipité.
- 4 -
1
/
4
100%