Groupage ABO (H) et Rhésus Standard : TP d'Hématologie

ETSL
LE GROUPAGE ABO (H) ET
RHESUS STANDARD
TP 2
GABIN-GAUTHIER
11/11/2009
I. HISTORIQUE ........................................................................................................................................................................ 2
II. GENERALITES SUR LES GROUPES ABO (H) ........................................................................................................................... 2
1. DEFINITION ......................................................................................................................................................................... 2
2. NATURE ET SYNTHESE DES AG ERYTHROCYTAIRES .......................................................................................................................... 3
3. ASPECTS GENETIQUES ............................................................................................................................................................ 3
3.1. L’ag H ...................................................................................................................................................................... 3
3.2. Les Ag A et B ............................................................................................................................................................ 4
4. REGLES TRANSFUSIONNELLES ................................................................................................................................................... 4
III. GENERALITES SUR LE SYSTEME RHESUS .......................................................................................................................... 4
IV. DETERMINATION DES GROUPES ABO (H) ........................................................................................................................ 5
1. PRINCIPE ............................................................................................................................................................................ 5
2. TECHNIQUE SUR LAME ........................................................................................................................................................... 6
2.1. Préparation de l’échantillon ..................................................................................................................................... 6
2.2. Témoins ................................................................................................................................................................... 6
2.3. Epreuve globulaire de Beth Vincent .......................................................................................................................... 7
2.4. Epreuve sérique de Simonin ...................................................................................................................................... 7
V. DETERMINATION DU RHESUS STANDARD ........................................................................................................................... 7
1. PRINCIPE ............................................................................................................................................................................ 7
2. TECHNIQUE SUR LAME ........................................................................................................................................................... 7
VI. FEUILLE DE RESULTATS .................................................................................................................................................... 9

2
K. Gabin-Gauthier, ETSL
LE GROUPAGE ABO (H) ET RHESUS STANDARD
TP 2
I. Historique
Les 1ers essais de transfusions sanguines remontent au milieu du XVIIème siècle (vers 1622) par le médecin
britannique Richard Lower, qui transféra du sang des veines d’un chien à un autre chien. Deux ans plus tard, le
médecin français Jean Denis fut le 1er à transférer du sang d’un animal à un jeune garçon anémique de 16 ans.
Des accidents mortels se multiplièrent et les transfusions furent interdites mais reprirent à la fin du XIXème
siècle grâce aux travaux du chirurgien anglais J. Bludell. Cependant des accidents hémolytiques graves
survenaient fréquemment et si la transfusion réussissait parfois, elle ne faisait souvent que précipiter le décès
(agglutination puis lyse des hématies, destruction des reins etc.).
Karl Landsteiner, médecin et biologiste autrichien, se proposa de surmonter ces difficultés et il avait observé,
en mélangeant du sang de plusieurs personnes, qu’il y avait parfois une agglutination des hématies et parfois non.
Il a ainsi classé les sangs humains en groupes A, B, O et AB et a montré que la transfusion sanguine était sans
risque entre des individus possédant le même groupe sanguin. Il a obtenu le prix Nobel en 1930 pour cette
découverte.
Cette découverte se prolonge en 1940, en collaboration avec les américains Levine et Wienner, par la
découverte du d=système Rhésus puis du système M et N.
Depuis d’autres systèmes ont été découverts à la surface des hématies comme par exemple Lewis, Kell, Duffy,
Kidd etc. Les plus importants, pour les transfusions sanguines, sont les sytèmes ABO (H) et Rhésus standard.
II. Généralités sur les groupes ABO (H)
1. Définition
Ils se définissent par la présence où l’absence :
D’Ag de nature glycoprotéique à la surface des globules rouges (Ag A, Ag B, Ag H) encore appelés
agglutinogènes.
D’Ac dans le plasma (Ac antiAg A, Ac antiAgB) encore appelés agglutinines. Ces Ac sont dits
naturels, car ils sont présents dans le sang en l’absence de toute immunisation connue (ils
apparaissent pendant les 3 à 6 premiers mois après la naissance)
Un individu donné possède toujours dans son plasma des agglutinines spécifiques d’agglutinogènes (Ag) non
présents sur ses hématies.
Groupes
Antigène
érythrocytaire
Anticorps plasmatique
Fréquence en France
A
Ag A
Ac antiAgB
45%
B
Ag B
Ac antiAgA
9%
AB
Ag A et Ag B
-
3%
O
Ag H
Ac antiAgB et Ac
antiAgA
43%

3
K. Gabin-Gauthier, ETSL
Rq : Cette répartition des groupes sanguins peut présenter de fortes différences en fonction des origines
ethniques des individus (68% de O et 32% de B chez les arborigènes d’Australie ; 100% de O pour les Indiens
du Pérou, majorité de B chez les asiatiques etc.)
Les Ag H sont des précurseurs nécessaires à la synthèse des Ag A et des Ag B.
Il existe également des sous groupes pour le groupe A : A1 et A2. Les globules rouges dits A1 possèdent
beaucoup d’Ag A à leur surface, masquant l’Ag H. Les globules rouges dits A2 possèdent peu d’Ag A à leur
surface et beaucoup d’Ag H.
2. Nature et syn thèse des Ag érythrocytaires
Ce sont des glycoprotéines. La structure supportant la spécificité repose sur l’assemblage de 2 ou 3 oses
précis : L-Fucose, N-acétyl-glucosamine, N-acétyl-galactosamine, D-Galactose (cf. schéma ci-dessous).
L’Ag H est nécessaire à la fabrication ultérieure des ag A et B et il persiste en général sur les hématies A, B et
AB des Ag H non modifiés ; il n’existe donc pas chez l’homme d’Ac anti Ag H humains.
3. Aspects g éné tiq ues
3.1. L’ag H
Il est codé par un gène présent sur le chromosome 19. Le gène présente 2 variants alléliques H et h :
L’allèle H code pour une enzyme, la Fucose transférase qui ajoute un fucose à l’extrémité terminale de la
chaîne glucidique, formant ainsi l’Ag H.
L’allèle h est un gène amorphe et non fonctionnel dont la présence en 2 exemplaires (homozygote) est
responsable de l’absence d’Ag H à la surface des hématies : le phénotype Bombay (observé pour la 1ère
fois en Inde). Ce phénotype Bombay est très rare et ces individus présentent donc des Ac anti Ag H
dans leur sérum.
Rq : 1 allèle correspond à différentes versions d’un même gène, situé sur un même site chromosomique (locus).

4
K. Gabin-Gauthier, ETSL
3.2. Les Ag A et B
Ils sont codés par un gène porté par le chromosome 9. Le gène présente 4 variants alléliques A1, A2, B et O :
L’allèle A1 code pour une enzyme très active, la N-acétyl-D-galactosamine transférase, rajoutant un N-
Acétyl-galactosamine à l’extrémité osidique, sur presque tous les Ag H (ils se retrouvent ainsi masqués).
L’allèle A2 code pour une enzyme moins active, la N-acétyl-D-galactosamine transférase, rajoutant un N-
Acétyl-galactosamine à l’extrémité osidique, sur quelques Ag H (il persiste donc beaucoup d’Ag H).
L’allèle B code pour une enzyme, la D-galactosyl transférase, ajoutant un D-galactose à l’extrémité
osidique.
L’allèle O est dit nul ou non fonctionnel et ne produit aucune enzyme active. A l’état homozygote, il
conduit à l’absence d’Ag A et d’Ag B sur les hématies (phénotype O).
Les allèles A et B sont codominants, l’allèle O est récessif.
Génotype (Allèles)
Phénotypes (groupes sanguins)
H/H ou H /h
A1/O ou A1/A1 ou A1/A2
A1
H/H ou H /h
A2/O ou A2/A2
A2
H/H ou H /h
B/O ou B/B
B
H/H ou H /h
A1/B
A1B
H/H ou H /h
A2/B
A2B
H/H ou H /h
O/O
O
h/h
?
Oh ou Bombay
4. Règles t ran sfusionn elles
Aujourd’hui, pour éviter tout risque, ce sont les transfusions isogroupes qui sont le plus souvent réalisées.
Cependant, en cas de difficultés d’approvisionnement, on peut utiliser les règles transfusionnelles classiques
(voir schéma ci-dessous). Le groupe O est dit « donneur universel », le groupe AB est dit « receveur universel ».
Attention, il ne faut pas oublier de tenir compte de la compatibilité Rhésus standard.
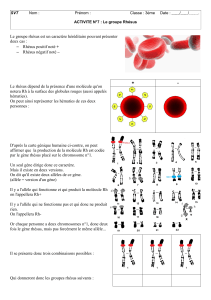
III. Généralités sur le système rhésus
Il possède un intérêt considérable en transfusion sanguine et en obstétrique pour les femmes. Sa connaissance
permet de réduire de 95% les risques d’immunisation suite à une transfusion sanguine et permet également de
prévenir le risque d’immunisation foeto-maternelle (cas d’une mère Rhésus - portant un enfant Rhésus +). Il a
ainsi été nommé car Landsteiner et Wiener, ont en 1940, immunisé un lapin avec des globules rouges d’un singe
espèce Macaccus rhesus et les Ac ainsi produit se sont avérés réagir avec 85% des globules rouges humains
(porteurs de l’Ag D ou rhésus standard +).

5
K. Gabin-Gauthier, ETSL
En fait, il existe 49 Ag Rhésus différents mais seuls 5 ont une importance en transfusion : Ag D, Ag C, Ag c, Ag
E, Ag e.
L’expression de ces Ag est contrôlée par 3 gènes voisins, qui se transmettent ensemble et situés sur le
chromosome 1.
Le 1er gène code pour une protéine RHD (Ag D) exprimée à la surface des globules rouges. Cette protéine est
présente chez 85% des individus en France, et ils sont dits de phénotype Rhésus positif (Rh+ ou D+). Chez les
sujets dits de phénotype Rhésus négatif (Rh – ou D-), le locus RHD est absent, ce qui à l’état homozygote
conduit à l’absence d’Ag D sur la membrane des globules rouges. Le gène D est dominant.
Les 2 autres gènes codent pour des protéines dites RHCE et existent chacun sous 2 allèles différents C et c, e
et E, qui vont respectivement coder pour les Ag C, c, c et E. Les différents allèles sont codominants.
Phénotype
Génotype le plus
probable
Fréquence en France
Rhésus Standard
D+C+E-c+e+
DCE/dce
34%
Rh +
≈ 85%
D+C+E-c-e+
DCE/DCe
20%
D+C+E+c+e+
DCe/DcE
13%
D+C-E+c+e+
DcE/dce
12%
Autres D+
divers
6%
D-C-E-c+e+
dce/dce
15%
Rh –
≈ 15%
Autres D-
divers
< 1%
Contrairement aux Ac anti Ag A ou anti Ag B dits naturels, la grande majorité des Ac dans le système rhésus
résultent d’une réponse immunitaire induite par une grossesse ou par une transfusion sanguine incompatible.
L’Ag D est le plus immunogène, suivi par les Ag E et c.
La compatibilité Rhésus standard (Ag D) est donc obligatoire en transfusion sanguine. Les Ac anti Ag D sont les
plus fréquemment impliqués dans les problèmes d’incompatibilité fœto-maternelle, on les appelle couramment les
« agglutinines irrégulières » ou « Ac irréguliers ». Le risque survient lorsqu’une femme Rh- porte son deuxième
enfant Rh+, et lorsqu’au cours de la première grossesse il y a eu passage accidentel du sang du bébé vers celui
de la mère. En l’absence de traitement, il y a donc un risque de production par la mère d’Ac anti Ag D, qui
pourront passer la barrière placentaire et attaquer les globules rouges du deuxième enfant Rh + provoquant
ainsi la maladie « hémolytique du nouveau-né ».
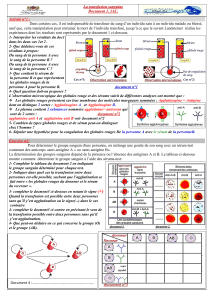
IV. Détermination des groupes ABO (H)
1. Princ ipe
On doit réaliser deux épreuves d’agglutination active directes, simultanément (hématies et sérum à tester
provenant du même sang) :
Epreuve globulaire dite de Beth Vincent dans laquelle on teste les globules rouges du patient vis-à-vis
d’Ac agglutinants connus pour identifier les Ag portés par les globules rouges du patient.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%