V - MP Star

L'étude expérimentale présente un certain nombre de dangers. Des produits
concentrés dangereux sont utilisés : eau de Javel, eau oxygénée,...
Le port des lunettes de protection est obligatoire.
1 - Principe des protections chimiques du fer :
On cherche à réaliser un état thermodynamique stable. Deux options se présentent :
(1) : déplacer le point représentatif dans le domaine
d'immunité
(2) : déplacer le point représentatif dans le domaine de
passivité.
Ces protections sont qualifiées de chimiques.
Rq : Il existe également des méthodes de protection physique, consistant à entourer le fer d'une pellicule
protectrice : - peinture anti-rouille, à base de minium
43
OPb
- film de matière plastique (ex : grillage plastifié)
- caoutchouc.
2 - Déplacement du fer dans son domaine d'immunité :
21 - Principe :
a] Aspect thermodynamique :
On associe au fer un métal M plus réducteur.
Le métal associé subit alors la corrosion.
En milieu naturel humide, cette protection est efficace. Mais en milieu extrême de corrosion, les deux
métaux sont oxydés.
On utilise généralement du zinc :
(
)
VZnZnE 76,0/
2
−=°
+
S'il recouvre entièrement le fer, ce dernier n'est plus en contact avec l'électrolyte. Sous les conditions
naturelles de corrosion, et en présence d'oxygène et de dioxyde de carbone, le zinc se revêt d'une couche
protectrice d'hydrocarbonate de zinc, et se retrouve alors dans son domaine de passivité. La protection est ainsi
parfaite.
40% de la production française de zinc sert à la protection contre la corrosion.
b] Mise en évidence expérimentale :
Les clous en fer utilisés dans cette expérience ne doivent pas être trop neufs, ni galvanisés. L'idéal est
de les prendre déjà un peu rouillés, et de bien les décaper au préalable.
PROTECTIONS CHIMIQUES CONTRE LA
CORROSION DU FER
E (V)
pH
Corrosion
Passivité
Immunité
(2)
(1)
E° (V)
- 0,44 Fe
2+
/Fe
M
n+
/M
Approche
expérimentale

Verser de l'eau de Javel concentrée dans les trois béchers représentés ci-dessous :
Expérience :
Clou en fer
Clou en fer avec
enroulement de zinc
Clou en fer avec
enroulement de cuivre
Observations :
Interprétation :
Données :
(
)
VCuCuE 34,0/
2
=°
+
;
(
)
VZnZnE 76,0/
2
−=°
+
;
(
)
2
/ 0,44
E Fe Fe V
+
° = −
.
22 - Anode sacrificielle :
a] Principe :
On réalise une pile de corrosion en reliant le fer à une électrode en métal plus réducteur.
A l'anode a lieu l'oxydation du zinc :
−+
+→ eZnZn 2
2
. D'où le terme d'anode "sacrificielle".
A la cathode a lieu la réduction de l'eau.
Avantage de la méthode : elle est facile à mettre en œuvre.
Inconvénient : la protection cesse dès que l'anode est entièrement corrodée. D'où la nécessité d'une
maintenance.
Applications : coques de navire, canalisations enterrées, chauffe-eau électriques.
b] Mise en œuvre expérimentale :
Réaliser la pile de corrosion ci-après. Mesurer la fem.
Basculer ensuite le multimètre en position ampèremètre afin que la pile débite.
Canalisation
en fer enterrée
Anode
en zinc

Indiquer la polarité de la pile, le sens du courant et celui des
électrons.
Préciser quelles sont l'anode et la cathode.
Ecrire les réactions électrochimiques :
Anode :
Cathode:
V
Fe Zn
c] Aspect cinétique en milieu non aéré :
Traçons les courbes intensité - potentiel relatives aux demi-réactions précédentes, sachant que la
surtension cathodique du couple H
+
/ H
2
sur une électrode de fer est η
K
= - 0,2V, et en supposant pH = 7 :
−−
+→+ OHHeOH
22
2
1
E
cathode
= 0,00 - 0,06 pH = - 0,42V pour une pression en
dihydrogène
2
1
=
H
p bar
.
E
anode
≈ E°(Zn
2+
/Zn) = - 0,76V
Graphiquement, on trouve un potentiel de corrosion en M:
E
corr
≈ - 0,70V.
23 - Revêtement métallique :
On applique un revêtement de zinc sur le fer. Deux
méthodes existent : l’électrozingage et la
galvanisation.
En cas de rayure, on réalise alors une pile de corrosion
dans laquelle le zinc s'oxyde.
a] Electrozingage (ou électrozincage) :
L'électrozingage consiste à réaliser un dépôt électrolytique de zinc sur le fer.
Les revêtements obtenus ont une épaisseur allant de 5 à 10 µm.
Mise en œuvre expérimentale :
Nettoyer préalablement un clou à la toile
émeri.
Une pince crocodile en fer permet de tenir le
clou.
Mettre en place l'électrolyse. Ajuster la tension
pour que l'intensité soit de 0,2 A.
Poursuivre l'électrolyse pendant 5 mn.
Indiquer le sens du courant et celui des
électrons.
Préciser quelles sont l'anode et la cathode.
Zn
Clou
Pince de
fer
ZnCl
2
200 gL
-
1
V
A
Electrolyte : NaCl 3%
Eau + air
Fer
Zinc
i
corr
-i
corr
i
A

Ecrire les réactions électrochimiques :
Anode :
Cathode:
En supposant le rendement faradique égal à 100%, calculer la masse de zinc déposée sur le fer. On
donne la masse molaire du zinc : M
Zn
= 65,4 gmol
-1
.
Exercice d’approfondissement : voir dernière page.
b] Galvanisation :
La galvanisation consiste à immerger de l'acier dans un bain de zinc fondu à 450 °C.
Température de fusion du zinc : 419 °C
Température de fusion du fer : 1535 °C.
Cette méthode est utilisée depuis le milieu du XIX
ème
siècle.
La galvanisation permet un dépôt plus adhérent que l’électrozingage.
c] Aspect cinétique du revêtement de zinc :
Les évaluations E
anode
(Fe/Fe
2+
) = -0,62 V et E
cathode
(O2/H2O) = 0,80 V avec η
K
= - 0,60 V ont été
effectuées dans le TP précédent, en milieu neutre oxygéné.
−+ +→ eZnZn 2
2
:
( )
2
2
0
0,06
/ 0,76 log
2
anode
Zn
E Zn Zn
C
+
+
=− +
Prenons
2 6 1
10
Zn molL
+ − −
=
, il vient :
(
)
2
/ 0,94
anode
E Zn Zn V
+
=−
. Le système est rapide.
L’oxydation du zinc est favorisée, aussi bien sur le plan thermodynamique que sur le plan cinétique. En
effet, le courant de corrosion est beaucoup plus élevé que pour le fer seul : tant qu’il y aura du zinc, le fer sera
protégé.
-
0,62
V (V)
0,80
0,2
0
-
0,94
E
corr
E’
corr
i
corr
i’
corr
O
2
H
2
O

24 - Protection cathodique :
La méthode consiste à baisser électriquement le potentiel du fer, en imposant une tension
3 - Déplacement du fer dans son domaine de passivité :
Quatre méthodes sont généralement employées :
(1) : passivation
(2) : alcalisation
(3) : revêtement métallique
(4) : protection anodique.
31 - Passivation :
La passivation consiste à faire agir sur le fer une espèce plus oxydante, afin d’augmenter son potentiel.
Le fer s'oxyde, et se recouvre d'une fine couche protectrice d'oxyde ferrique
32
OFe
.
On utilise généralement de l'eau oxygénée ou des nitrates.
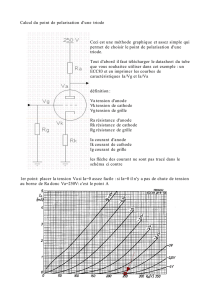
a] Mise en œuvre expérimentale :
Utiliser des gants : l’eau oxygénée est très oxydante.
Réaliser la pile ci-contre.
Mesurer au bout d'une minute les valeurs du potentiel
d'électrode et du pH.
L’électrode de référence au calomel saturé a un
potentiel de 244 mV à 25°C, et celle au sulfate
mercureux, un potentiel de 657 mV à 25°C.
Laisser agir la passivation
mn5
Placer le point représentatif mesuré sur le diagramme
potentiel-pH du fer.
Conclure :
E (V)
pH
V
Corrosion
1 volume de
22
OH
pour
1 volume de tampon pH = 7
Fer
Passivité
Electrode de
référence
Electrode inerte
(ex : graphite)
Immunité
Fer
Milieu
conducteur
e
(2)
(1)
Application : gros œuvres
enterrés ou immergés :
pipelines, sealines, carènes
de navires,...
 6
6
 7
7
 8
8
 9
9
1
/
9
100%