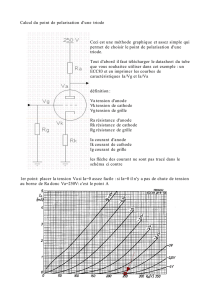
Corrosion et anode sacrificielle : Exercices de chimie

Corrosion et anode sacrificielle
● La corrosion des métaux est un phénomène courant : le métal réagit par réaction chimique avec
un oxydant (le dioxygène O
2
le plus souvent).
● A part les métaux nobles comme l’or, le platine et l’argent, les autres métaux s’oxydent
naturellement à l’air libre à cause du dioxygène de l’air (exemples : Fe
2
O
3
, Al
2
O
3
).
● Les milieux électrolytiques, comme l’eau de mer, accélèrent le phénomène corrosion.
● Ce système constitue une pile électrochimique : le métal de fer jouant le rôle de la cathode, le
zinc celui de l’anode.
Réalisation d’une pile électrochimique
1- A partir des informations dans les documents, indiquer sur la pile du document 1 :
- Le mouvement des porteurs de charges à l’intérieur et à l’extérieur de la pile.
- Les équations qui se déroulent au niveau de l’électrode de fer et de cuivre.
- L’anode et la cathode.
- Les polarités de la pile.
- Le sens du courant électrique.
2- Réaliser différentes piles à l’aide du matériel nécessaire. Écrire les équations se déroulant à
l’anode et la cathode.
Document 1 : Pile électrochimique
Une pile est constituée de deux demi-piles reliées électriquement par un pont salin. Le cas le
plus simple est la demi-pile constituée par une électrode métallique solide, plongeant dans une
solution aqueuse contenant le cation métallique de la même espèce. Par exemple, une lame
métallique de cuivre (Cu
(s)
) plongeant dans une solution de sulfate de cuivre (Cu
2+(aq)
,
2-(aq) 4
SO )
constitue une demi-pile.
Schéma d’une pile cuivre-Zinc avec le mouvement des porteurs de charges (historiquement
appelée pile Daniell)
Le pont salin assure une liaison électrique entre les deux demi-piles et permet de respecter
l’électroneutralité de chacune des demi-piles.
A l’extérieur de la pile, seuls les électrons circulent et à l’intérieur de la pile, ce sont les ions et
uniquement eux qui assurent le passage du courant.
Document 2 :
Anode et cathode
●
L’
anode
est le siège d’une
oxydation
: il y a une perte d’électrons à cette électrode.
●
La
cathode
est le siège d’une
réduction
: il y a un gain d’électrons à cette électrode.
Définitions :
L’anode est le siège d’une oxydation : il y a
une perte d’électrons à cette électrode.
La cathode est le siège d’une réduction : il y a
un gain d’électrons à cette électrode.
Moyen mnémotechnique :
Anode et oxydation commencent par une
voyelle.
Cathode et réduction commencent par une
consonne.
R A
Zn
(s)
Cu
(s)
Pont salin
2
SPE

Anode sacrificielle
Document 1 :
Anode sacrificielle
Une anode sacrificielle est une pièce métallique permettant, via sa consommation, la
d'un autre élément métallique.
La corrosion galvanique est due à la différence de potentiel de métaux en contact, ou reliés entre
eux, plongés dans un électrolyte, comme l'eau de mer : une pile est ainsi formée.
Le fer est un métal beaucoup uti
construction des coques de bateaux. Soumis à l’action de l’eau et du dioxygène, le fer s’oxyde
parle de corrosion.
Afin d’éviter ce problème, on accole sur les coques de bateaux des blocs de
place du fer
: c’est une anode sacrificielle. La coque du bateau est ainsi protégée tant que le bloc
de zinc n’est pas entièrement consommé.
Document 2 : Divers tests
Clou en acier enroulé par un fil
Ion à tester
Fe
3+
(aq)
Zn
2+
(aq)
OH
-
(aq)
Document 2 :
Pile électrochimique
Le fer et le zinc forment alors une pile électrochimique qui peut être décrite selon le schéma ci
dessous. L’eau de mer, solution électrolytique, joue le rôle du pont salin. La densité de courant qui
s’établit est j = 0,100 A.m
-2
.
Zn
2+
(aq)
Zn
s)
Anode sacrificielle
Une anode sacrificielle est une pièce métallique permettant, via sa consommation, la
La corrosion galvanique est due à la différence de potentiel de métaux en contact, ou reliés entre
eux, plongés dans un électrolyte, comme l'eau de mer : une pile est ainsi formée.
Le fer est un métal beaucoup uti
lisé dans le domaine de la métallurgie, notamment dans la
construction des coques de bateaux. Soumis à l’action de l’eau et du dioxygène, le fer s’oxyde
Afin d’éviter ce problème, on accole sur les coques de bateaux des blocs de
: c’est une anode sacrificielle. La coque du bateau est ainsi protégée tant que le bloc
de zinc n’est pas entièrement consommé.
Clou en acier enroulé par un fil
de zinc Clou en aci
er enroulé par un fil de cuivre
Réactif
Ion hexacyanoferrate (II)
soude
Phénolphtaléine
Pile électrochimique
Le fer et le zinc forment alors une pile électrochimique qui peut être décrite selon le schéma ci
dessous. L’eau de mer, solution électrolytique, joue le rôle du pont salin. La densité de courant qui
R
(aq)
+
2-(aq) 4
SO
Fe
2+(aq)
+
2-(aq) 4
SO
Fe
(s)
Pont salin
Une anode sacrificielle est une pièce métallique permettant, via sa consommation, la
protection
La corrosion galvanique est due à la différence de potentiel de métaux en contact, ou reliés entre
eux, plongés dans un électrolyte, comme l'eau de mer : une pile est ainsi formée.
lisé dans le domaine de la métallurgie, notamment dans la
construction des coques de bateaux. Soumis à l’action de l’eau et du dioxygène, le fer s’oxyde
: on
Afin d’éviter ce problème, on accole sur les coques de bateaux des blocs de
zinc qui s’oxydent à la
: c’est une anode sacrificielle. La coque du bateau est ainsi protégée tant que le bloc
er enroulé par un fil de cuivre
Ion hexacyanoferrate (II)
Le fer et le zinc forment alors une pile électrochimique qui peut être décrite selon le schéma ci
-
dessous. L’eau de mer, solution électrolytique, joue le rôle du pont salin. La densité de courant qui

Données :
1 mol d’électrons a une charge q = 9,65.10
4
C
Le fer appartient au couple Fe
2+
/ Fe, le zinc au couple Zn
2+
/ Zn.
La charge électrique Q est reliée avec le courant I et le temps ∆t est : Q = I.∆t avec Q en C, I en A
et ∆t en s.
La variation de masse au niveau des électrodes est donnée par la relation suivante :
∆m =
2F
t.M∆I.
1- Expliquer pourquoi le zinc permet de protéger le fer de la corrosion. Expliquer le terme d’anode
sacrificielle.
2- Déterminer la masse minimale de zinc à accoler sur la coque pour protéger une coque de 50,0
m
2
pendant un an.
3- Que peut-on dire du résultat obtenu ?
Compétences
travaillées Critères de Réussite A B C D
S’approprier
Identifier un problème le formuler
Analyser
Construire les étapes d’une résolution de problème
Réaliser
Savoir réaliser un montage d’une pile électrochimique
1
/
3
100%