tsti2dae11B Comment protéger le fer de la corrosion

11
B
Activité
expérimentale Comment protéger le fer de la corrosion ? T
STI2D
Capacités : -
Illustrer le rôle des différents facteurs agissant sur la corrosion des métaux et le
vieillissement des matériaux
-
Prévoir différents moyens de protection et vérifier
expérimentalement leur efficacité
Problème à résoudre…
Les coques (et les hélices) de nombreux bateaux sont en acier, alliage très
résistant aux chocs. Cependant, le fer dont il est composé en majorité a
l’inconvénient de se corroder facilement : il s’oxyde et ce d’autant plus
facilement que le milieu est humide est salé. Pour lutter contre le phénomène de
corrosion, l’industrie navale fixe sur les coques en acier des pièces métalliques,
en zinc, métal plus réducteur que le fer.
Exemple de pièces en zinc
sous la coque d’un navire
.
Problème : Comment des pièces en zinc peuvent-elles prévenir
le phénomène de corrosion ?
Données pour toute l’activité:
couples redox : Fe
2+
/Fe ; Zn
2+
/Zn ; Cu
2+
/Cu ; O
2
/HO
-
(demi-équation associée : O
2
+ 2 H
2
O + 4
e
–
= 4
HO
–
)
Réfléchissons un peu avant de commencer…
Qu’est-ce qui différencie le fer de l’acier ?
A la suite de plusieurs oxydations, que forme le fer sur les coques des bateaux ?
Pourquoi est-ce particulièrement dommageable pour les coques des bateaux ?
Que signifie « métal plus réducteur » ?
Quelle est la demi-équation électronique modélisant l’oxydation du fer métallique ?
Mise en évidence du phénomène de corrosion et de protection
Pour mettre en évidence les phénomènes, on utilisera des clous en fer décapés.
Une solution chaude de gélifiant (agar-agar), d’eau salée, d’hexacyanoferrate(III) de potassium, de
phénolphataléïne est disponible au bureau (au chaud, agitée).
Placer dans chacune des deux boîtes de Pétri à votre disposition :
- un clou en fer au milieu duquel est enroulé un morceau de cuivre (décapé)
- un clou en fer au milieu duquel est enroulé un morceau de zinc (décapé)
Verser délicatement quelques mL de solution chaude d’eau salée pour recouvrir totalement les clous et
laisser gélifier quelques minutes.
A l’aide du
doc.1
ci-dessous, justifier l’ajout d’hexacyanoferrate de potassium et de phénolphtaléïne dans la
solution d’eau salée.
Quel est l’intérêt pratique d’utiliser un gélifiant ?
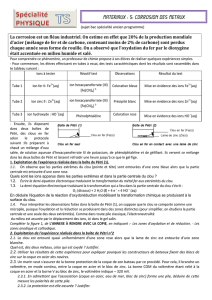
Noter vos observations sur les schémas ci-dessous du
doc.2
. (le clou en fer nu est sur le bureau). Préciser
quels ions se sont formés sur chaque partie du clou.
En déduire les équations des demi-équations redox traduisant les transformations observées dans les
différentes parties du clou.
Dans quel cas le fer a-t-il été corrodé ? Quel clou a donc été protégé de la corrosion ?
Utiliser les résultats de cette expérience pour expliquer pourquoi les constructeurs de bateaux fixent des
blocs de zinc sur la coque en acier des navires.
http://lefevre.pc.free.fr

Interprétation de la protection grâce aux piles électrochimiques
Pour interpréter les observations faites dans la boîte de Pétri, on suppose que le clou se comporte comme une
micropile, puisque l'oxydation et la réduction se produisent dans des zones distinctes (pour simplifier, on
étudiera la partie centrale et l’une seulement des deux extrémités du clou).
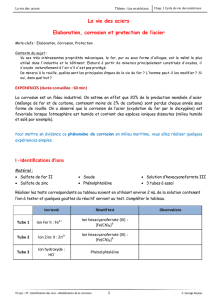
Réaliser deux piles en plongeant deux lames métalliques dans une solution d’eau salée (avec quelques mL
d’hexacyanoferrate de potassium et de phénolphtaléïne) :
- pile 1 : lames de fer et de cuivre - pile 2 : lames de fer et de zinc
Mettre les deux piles en même temps en fonctionnement une dizaine de minutes en reliant chaque borne à un
ampèremètre (voir schéma ci-dessous du
doc.3
).
Noter vos observations sur les schémas du
doc.3
. Préciser quels ions se sont formés sur chaque électrode.
Noter sur les schémas les pôles positifs et négatifs de chaque pile, le sens de circulation des électrons.
Dans quelle pile le fer est-il oxydé ?
Pour éviter la corrosion, l’électrode de fer doit-elle être l’anode ou la cathode ?
Pourquoi les blocs de zinc sur les coques des bateaux doivent-ils être changés régulièrement ?
Expliquer pourquoi cette protection est appelée « protection cathodique par anode sacrificielle » ?
En 1824, l’anglais Humphry Davy eut l’idée pour la première fois de fixer sur la coque en cuivre d’un navire
des blocs de fer. Etait-ce judicieux ?
Document 1
ion à tester réactif test si test positif
Fe
2+
ion hexacyanoferrate
coloration bleue
Zn
2+
ion hexacyanoferrate
précipité blanc
HO
–
phénolphtaléïne coloration rose
Document 3
Document 2
Conclusions
Rédiger avec le professeur une conclusion.
Pour les plus rapides
Vérifier qu’un clou vernis ou peint se corrode difficilement. Proposer une expérience et une interprétation.
A
Eau salée
+ réactifs tests
Lame de
Zn
Plaque de fer
A
Eau salée
+ réactifs tests
Lame de
Cu
Plaque de fer
pile 1
pile 2
Cu
Zn
Cu
http://lefevre.pc.free.fr
1
/
2
100%