TBEP 31 janvier 2005 Une pile est constitué de deux couples

TBEP 31 janvier 2005
PhG-Sciences
pont salin
V
lame de
cuivre
sulfate
de cuivre
sulfate
de zinc
lame de
zinc
Une pile est constitué de deux couples oxydant-réducteur (deux demi-piles) reliés par un pont
électrolytique (ou pont salin).
I- Une pile électrochimique : la pile Daniell
1- Étude expérimentale
La pile Daniell est constituée d'une lame de cuivre plongeant dans une solution de sulfate de cuivre
(SO42– ; Cu2+) et d'une lame de zinc plongeant dans une solution de sulfate de zinc (SO42– ; Zn2+)
: c'est la pile Cu / Zn.
Le pont électrolytique ou pont salin est
constitué d'un papier imprégné de nitrate
d'ammonium ou d'un tube rempli d'un gel
agar-agar et de chlorure de potassium qui
permet le passage des ions.
Joint par un fil conducteur, un courant électrique circule.
Le voltmètre indique 1,10 V.
Le pôle + est l'électrode de cuivre (la cathode) et le pôle – est l'électrode de zinc (anode).
2- Point de vue électrique
Les potentiels ECu et EZn des couples Cu2+/Cu et Zn2+/Zn sont donnés par le tableau des potentiels
normaux d'oxydoréduction.
On relève : E°Cu = 0,34 V E°Zn = – 0,76 V
La f.é.m ECu/Zn de la pile Cu / Zn correspond à la différence de potentiel des deux couples.
ECu/Zn = ECu – EZn
d'où : ECu/Zn = 0,34 – (– 0,76)
soit : ECu/Zn = 1,10 V
La f.é.m ECu/Zn de la pile Cu / Zn est égale à 1,10 V.
L'électrode de zinc est l'anode et celle de cuivre est la cathode
3- Point de vue chimique
L'électrode négative, l'anode, cède les électrons. La lame de zinc est oxydée (elle est rongée).
La demi-équation a l'anode est : Zn Zn2+ + 2 e–
À la cathode, un dépôt de cuivre apparaît : les ions cuivre II sont réduits.
La demi-équation a la cathode est : Cu2+ + 2 e– Cu
L'équation-bilan de la pile s'écrit : Zn + Cu2+ Zn2+ + Cu

2e–
lame de cuivre
Cu
Sulfate de cuivre
(SO42–, Cu 2+)
Sulfate de zinc
(SO42–, Zn 2+)
lame de zinc
Zn
+
Zn 2+
Cu 2+
–
La lame de zinc libère 2 électrons ; un atome de zinc se transforme en un ion Zn 2+.
La concentration en ions Zn 2+ augmente.
Deux électrons sont capturés par un ion cuivre Cu 2+ ; un atome de cuivre est formé.
La concentration en ions Cu 2+ diminue.
II- Les piles
Deux constitutions de piles sont possibles.
- La pile est constituée de 2 demi-piles et dans chaque demi-pile se déroule une réaction chimique.
C'est le cas de la pile Daniell..
Une demi-pile libère des électrons, l'autre consomme des électrons.
- Deux lames de métaux différents plongent dans un électrolyte constituent aussi une pile.
Le métal le plus réducteur constitue le pôle – , l'anode (cède des électrons).
Le métal le plus oxydant constitue le pôle + , la cathode (capte des électrons).
Exemple : la pile est constituée de deux lames de zinc et de cuivre plongées dans une solution
acide.
A l'anode, le zinc est oxydé : Zn
Error!
Zn 2+ + 2 e –
A la cathode, les ions H3O + sont réduits : 2 H3O + + 2 e –
Error!
H2 + 2 H2O
Le dégagement de dihydrogène forme une enveloppe isolante autour de l'électrode de
cuivre empêchant le fonctionnement de la pile : elle se polarise.
La force électromotrice, f.é.m., d'une pile correspond à la différence de potentiel. Elle est d'autant
plus grande que les métaux sont distant dans la table des potentiels.
lame de cuivre
Cu
Solution acide
lame de zinc
Zn
V

TBEP 31 janvier 2005
PhG-Sciences
Exemple : ECu/Zn = ECu – EZn
Le potentiel normal d'une pile est déterminé pour une concentration des solutions, une
température et une pression données.
Application : Une pile est constituée d'une électrode de platine et d'une électrode de zinc
plongeant dans une solution aqueuse d'acide sulfurique. Prévoir sa f.é.m. et ses pôles.
III- Les piles usuelles
Une pile usuelle comprend :
- deux métaux différents (le métal du pôle + peut être remplacé par une électrode de carbone) ;
- un électrolyte gélifié (avec de l'agar-agar par exemple) ;
- un dépolarisant qui permet d'éviter la formation de gaz aux électrodes (ce gaz déforme et peut
faire exploser le boîtier et il diminue la f.é.m. de la pile et augmente sa résistance interne).
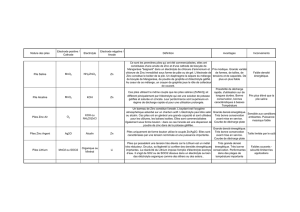
1- Piles salines (ou de type Leclanché)
Conçue il y a plus d'un siècle par Georges Leclanché (ingénieur français 1839-1889), le brevet de
1866 est celui d'une pile saline à dépolarisant.
L'électrolyte est une solution gélifiée de chlorure d'ammonium NH4Cl.
Le pôle – (l'anode) est en zinc. Le zinc est oxydé.
Le pôle + (la cathode) est l'électrode de graphique entourée de dioxyde de manganèse MnO2
Il y a oxydation du zinc et réduction du dioxyde de manganèse.
2- Piles alcalines
Les couples sont les mêmes mais l'électrolyte est une solution alcaline d'hydroxyde de potassium KOH.
Schéma des piles saline et alcaline (l'électrolyte diffère).
Ces piles sont vendues sous forme de
pile ronde de 1,5 V ou de pile plate
de 4,5 V constituée de trois piles
rondes en série.
3- Piles boutons
De faible encombrement, la pile bouton est utilisée pour l'alimentation des montres, des calculatrices,…
L'oxydant MnO2 est remplacé par de l'oxyde de mercure HgO ou de l'oxyde d'argent Ag2O.
La f.é.m de la pile au mercure est de l'ordre de 1,35 V.
pôle - (zinc)
électrolyte
(solution gélifiée)
dépolarisant
(dioxyde de manganèse)
pôle + (carbone)
contact -
contact +
isolant
capsule de laiton
(améliore le contact)

4- Autres types de piles
- Piles au lithium : le lithium est un métal alcalin de potentiel standard E°Li+/Li = – 3,03 V.
Comme ce potentiel est très négatif, le lithium réduit l'eau en dihydrogène. Il est donc
indispensable d'utiliser un électrolyte non aqueux, du dioxyde de soufre par exemple.
Elles existent dans une large gamme de tensions (de 1,5 V à 3,5 V), ont une excellente
conservation (15 ans) et une haute densité d'énergie (jusqu'à 420 Wh/kg)
- Piles air-zinc : c'est le dioxygène de l'air qui joue le rôle d'oxydant (à la place de MnO2 dans la pile
Leclanché). Ce sont des sources d'énergie autonome pour les régions éloignées (balisage maritime,
réémetteur de TV, bornes d'appel d'urgence,…).
- Piles amorçables à l'eau de mer : le pôle – est constitué de magnésium, le pôle + d'iodure de cuivre
et l'électrolyte l'eau de mer. Ces piles se déclenchent dès l'immersion. Elles sont destinées au
matériel de survie.
1
/
4
100%