Chapitre 1 : Les métaux

Chimie – Dossier 5 – Je retiens Page 1
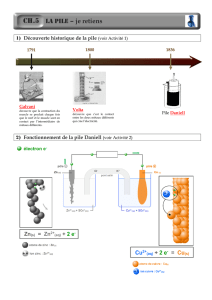
Galvani découvre que la
contraction du muscle se
produit chaque fois que le nerf
et le muscle sont en contact
par l’intermédiaire de métaux
différents.
Volta découvre que c’est le
contact entre les deux métaux
différents qui crée l’électricité.
Pile Daniell
1791
1800
1836
NOM : ………………………………………PRENOM : ……………………………………… CLASSE : ……………………………DATE : ………/………/………

Chimie – Dossier 5 – Je retiens Page 2
Pendant le fonctionnement de cette pile, les ions cuivre Cu2+ ont disparu (disparition de la coloration
bleue) et il s’est formé du cuivre métallique Cu (apparition du dépôt orange).
Il y a donc eu transformation chimique entre le zinc métallique Zn et les ions cuivre Cu2+ pour former du
cuivre métallique Cu et des ions zinc Zn2+.
Zn + Cu2+ Cu + Zn2+
Quand une pile fonctionne, elle s’use car elle consomme une partie des réactifs qu’elle contient
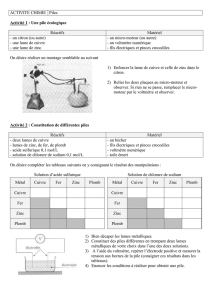
Il existe une tension entre une lame de cuivre et une lame
de zinc plongeant dans une solution de sulfate de cuivre II.
C’est une PILE ELECTROCHIMIQUE
Lorsque la pile fonctionne, on observe :
La décoloration de la solution,
Un dépôt de cuivre sur la lame de zinc
Une dégradation de la lame de cuivre.
Lors de la transformation chimique,
l’énergie chimique se transforme en :
ENERGIE ELECTRIQUE Une pile est
constituée de deux ELECTRODES de
natures différentes plongeant dans une
solution conductrice, appelée
ELECTROLYTE.
Ce que je dois savoir pour le contrôle :
Réaliser, décrire et schématiser la réaction entre une solution aqueuse de sulfate de cuivre et
la poudre de zinc par contact direct
Réaliser, décrire et schématiser la réaction entre une solution aqueuse de sulfate de cuivre et
la poudre de zinc en réalisant une pile
Citer les critères de reconnaissance d’une transformation chimique
Justifier l’usure d’une pile
Etablir le bilan énergétique d’une pile en fonctionnement (diagramme énergétique)
1
/
2
100%