chimie - page d`accueil

BACCALAURÉAT GÉNÉRAL
SESSION 2005
PHYSIQUE-CHIMIE
Série S enseignement de Spécialité
DURÉE DE L’ÉPREUVE : 3 h 30. – COEFFICIENT : 8
L’usage des calculatrices est interdit
Chaque exercice sera traité sur une copie séparée. Une
feuille blanche portant le nom du candidat et le numéro
de l’exercice devra être rendue pour tout exercice non
traité.
Ce sujet comporte un exercice de CHIMIE et deux exercices de PHYSIQUE présentés sur pages
numérotées de 1 à 6, y compris celle-ci.
Le candidat doit traiter les trois exercices, qui sont indépendants les uns des autres :
Chimie /6
Mouvements plans d’un pot de confiture /6
Cordes et lunette astronomique /6
1/6

CHIMIE
Partie A : « Autour de l’acide lactique »
Données :
Zones de virage des indicateurs colorés :
Indicateur coloré
Teinte acide
Zone de virage
Teinte basique
Rouge de méthyle
rouge
4,2-6,2
jaune
hélianthine
rouge
3,1-4,4
jaune
Vert de bromocrésol
jaune
3,8-5,4
bleu
pKe = 14,0 à 25°C ; 10-0,1 = 0,79 ; 10-0,8= 0,16
I) Réaction de l’acide lactique avec l’eau
L’acide lactique a pour formule CH3CHOHCO2H .
Ecrire l’équation de la réaction de l’acide lactique avec l’eau . La base conjuguée de l’acide lactique est
l’ion lactate , quelle est sa formule ?
II) Détermination du pKa du couple acide lactique/ion lactate
Une étude expérimentale a permis de tracer le diagramme de distribution des formes acide et basique du
couple acide lactique/ion lactate en fonction du pH à 25°C.
III) L’acide lactique dans le lait .
L’acide lactique peut se former par fermentation du lactose contenu dans le lait .
1°) A partir de l’équation de la réaction de l’acide lactique sur l’eau (écrite en I) , exprimer la constante
d’acidité KA du couple acide lactique/ ion lactate en fonction des concentrations des espèces présentes à
l’équilibre .(On notera AH pour l’acide lactique et A- pour l’ion lactate )
2°) Un lait a un pH de 6,0 à 25°C .
a) D’après la question II) 1), en déduire l’espèce prédominante dans ce lait .
b) Calculer, en utilisant l’expression de la constante d’acidité Ka, le rapport des
concentrations [A-]éq/[AH]éq dans le lait .Le résultat trouvé est-il en accord avec la
réponse à la question précédente ?
IV) L’acide lactique responsable des crampes !
La formation d’acide lactique , lors des efforts musculaires , est responsable des crampes ; sa base
conjuguée est au contraire sans effet .Pour lutter contre les crampes , on conseille de boire de l’eau
« basique ».Pour comprendre cette affirmation , on mélange de l’acide lactique et des ions hydroxyde.
1°) Ecrire l’équation de la réaction qui se produit .
2°) Calculer sa constante d’équilibre .Conclure .
3°) Justifier alors l’usage d’une boisson basique pour éviter les crampes dues à l’acide lactique .
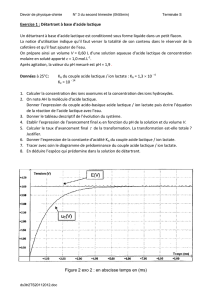
V) Préparation d’une solution d’acide lactique au laboratoire
On prépare une solution aqueuse S0 d’acide lactique de concentration apportée C0 = 1,0.10-2 mol.L-1 et de
volume V .La mesure de son pH donne 3,0 . 2/6
1°) Identifier la courbe correspondant à la forme acide et à la
forme basique du couple .
2°) En utilisant le diagramme ci-contre, justifier que le pKA du
couple acide lactique/ion lactate est 4,0 à 25°C. .
0 2 4 6 8 10 12 14 pH
20
40
60
80
100
%
(1)
(2)

1°) Dresser un tableau d’avancement ( avec des expressions littérales) correspondant à l’équation écrite
en IV I°) .
2°) Déterminer le taux d’avancement final de la réaction de l’acide lactique avec l’eau .Cette réaction
est-elle totale ?
3°) On prélève 10,0 mL de la solution S0 que l’on verse dans une fiole jaugée de 100,0 mL .Après avoir
complété la fiole jusqu’au trait de jauge avec de l’eau distillée , on obtient une solution S1 .
a) Calculer la concentration de la solution S1.
b) Pour déterminer un encadrement du pH de la solution S1 , on utilise 3 indicateurs colorés
.Les couleurs observées sont les suivantes :
hélianthine
Vert de bromocrésol
Rouge de méthyle
orange
jaune
rouge
En déduire l’encadrement de la valeur finale du pH de la solution S1 , puis du taux
d’avancement final de la réaction de l’acide lactique avec l’eau dans cette solution .
c) Quel est l’effet de la dilution sur la dissociation de cet acide dans l’eau ?
Partie B : Bilan de fonctionnement d’une pile
On considère une pile fer- cuivre dans laquelle interviennent les couples oxydo- réducteurs Fe2+/Fe et
Cu2+/Cu. Chaque demi pile contient 100 mL de solution de sulfate de l’ion métallique correspondant, de
concentration 0,1 mol/L. La lame de fer a une masse de 11,2 g, et celle de cuivre a une masse de 6,4g. La
pont salin est constitué d’ions ammonium NH4+ et d’ions nitrate NO3- On fait débiter cette pile dans un
conducteur ohmique, et on constate que l’électrode de fer est peu à peu rongée.
On donne: M (Fe ) = 56 g /mol. M (Cu) = 64 g / mol
1°) Faire un schéma de cette pile
2°) A partir des renseignements de l’énoncé, écrire les équations des réactions aux électrodes. Préciser où
ont lieu l’oxydation et la réduction. Identifier l’anode et la cathode. Quelle est la polarité des électrodes ?
3°) En déduire l’équation d’oxydo réduction spontanée qui se produit dans la pile.
4°) Indiquer, sur le schéma de la question 1°) : le pôle + et le pôle – de la pile, l’anode et la cathode, le
mouvement des différents porteurs de charge, et le sens conventionnel du courant, lorsque la pile débite.
5°) Quelle est la valeur du quotient de réaction initial Qri du système constituant la pile ? Soit K la
constante d’équilibre associée à cette réaction. Situer K par rapport à Qri.
6°) La pile débite un courant d’intensité constante I = 100 mA pendant t1 = 2 heures et 40 minutes.
a) Quelle est la quantité d’électricité mise en jeu ?
b) Sachant qu’une mole d’électrons transporte environ 96000 C, combien de moles d’électrons ont
transporté cette quantité d’électricité ?
c) En vous aidant d’une des demi équations, en déduire l’avancement de la réaction au bout des
2 h 40 minutes.
d) A l’aide d’un tableau d’avancement, déterminer la quantité de matière de chaque électrode, et la
concentration des ions cuivre II et fer II dans chaque bécher au bout des 2h 40 minutes.
7°) Comment peut on mesurer la force électromotrice de cette pile ?
3/6

Mouvements plans d’un pot de confiture
Cet exercice comporte 12 affirmations. A chaque affirmation vous répondrez par VRAI ou FAUX en
justifiant votre choix à l’aide de démonstrations et de définitions, de calculs, de schémas ou
d’analyses dimensionnelles. Toute réponse non justifiée ne rapportera aucun point.
1. On considère un pot de confiture évoluant dans le champ de
pesanteur terrestre supposé uniforme. Le projectile de masse m est
lancé à la date t=0s d’un point O d’altitude H, origine du repère
(O,x,z). Le vecteur vitesse initiale 0 fait un angle α avec
l’horizontale. Le mouvement s’effectue dans le plan vertical
contenant les axes Ox et Oz, tel que le champ de pesanteur est
parallèle à Oz. On se place dans le référentiel terrestre supposé
galiléen. On néglige toute résistance de l’air.
1.1 AFFIRMATION : le vecteur accélération G du centre d’inertie
G du pot de confiture ne dépend pas des conditions initiales.
1.2 AFFIRMATION : le projeté du centre d’inertie G du pot de confiture sur l’axe vertical Oz est animé
d’un mouvement rectiligne et uniforme.
1.3 AFFIRMATION : la trajectoire du centre d’inertie G du pot de confiture est parabolique quelque soit
α.
1.4 AFFIRMATION : Dans le cas où le pot de confiture est lancé d’une auteur H au dessus du sol avec
une vitesse 0 horizontale, l’abscisse de son point de chute est x=V0× 2H
g
2. On considère un satellite artificiel soumis uniquement à la force gravitationnelle de
la Terre. Le satellite de masse m, situé à l’altitude h par rapport au sol terrestre est
animé d’un mouvement circulaire et uniforme à la vitesse V. On se place dans le
référentiel géocentrique supposé galiléen.
données:
Le rayon de la Terre RT=6380km
La masse de la Terre MT=6.1024kg
La constante de gravitation universelle
G=7.10-11SI
2.1 AFFIRMATION : La constante de
gravitation universelle G s’exprime en
m/s².
2.2 AFFIRMATION : le vecteur accélération G du centre d’inertie du satellite est
dirigé vers le centre de la terre.
2.3 AFFIRMATION : la vitesse du satellite est donnée par la relation
V= G.MT
RT+h
Terre
RT
h
Satellite
sol
H
z
x
O
0
α

4/6
 6
6
 7
7
1
/
7
100%