la reaction chimique

LA REACTION CHIMIQUE.
Pour illustrer l'étude d'une réaction chimique, nous étudierons la combustion de l'éthanol.
La combustion d'un alcool est une oxydation complète car la chaîne carbonée est détruite.
La formule générale d'un alcool étant CnH2n+2O, l'équation de la combustion d'un alcool est :
CnH2n+2O + ............O2 ……… CO2 + …………… H2O
Cette réaction produit de la chaleur, mais ne présente pas d'intérêt en chimie organique car la molécule est détruite.
1. ÉQUATION CHIMIQUE.
On fait brûler de l'éthanol dans une éprouvette à gaz : on observe l'apparition de buée sur la paroi de l'éprouvette
et un fort dégagement de chaleur.
Après la combustion, si on verse de l'eau de chaux dans l'éprouvette, elle se trouble.
• Faire le bilan de cette réaction :
Réactifs
Produits
Nom
Formule
• Ajuster les coefficients stoechiométriques de l'équation chimique :
Elément C : C2H6O + …….. O2 ……. CO2 + ......... H2O
Elément H : C2H6O + …….. O2 ……. CO2 + ......... H2O
Elément O : C2H6O + …….. O2 ……. CO2 + ......... H2O
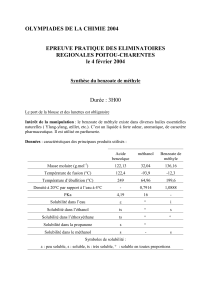
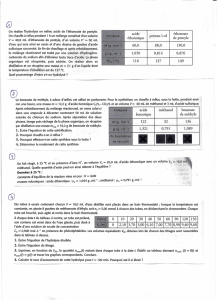
2. BILAN DE MATIÈRE.
On réalise la combustion de 4,6 g d'éthanol dans 20 L de dioxygène.
Calculer la masse d'eau obtenue et le volume de dioxyde de carbone obtenu.
Données :
- Masses molaires : M(H) = 1 g . mol-1 ; M(C) = 12 g . mol-1 ; M(O) = 16 g . mol-1
- Volume molaire des gaz dans les conditions de l'expérience : Vm = 25 L . mol-1'
Tableau descriptif :
Équation
C2H6O + 3 O2 2 CO2 + 3 H2O
État du système
avancement
n(C2H6O)
n(O2)
n(CO2)
n(H2O)
État initial
0
……………
……………
0
0
État inter
x
……………
……………
……………
……………
État final
……..
……………
……………
……………
……………

2.1. État initial
(a) Calculer la masse molaire de C2H6O : ……………...………………………………………………….
(b) En déduire le nombre de moles de C2H6O initialement présent : ……………………………………...
(c) Déterminer le nombre de moles de O2 initialement présent : ………………………………………….
(d) Remplir la 1ere ligne du tableau.
2.2. État intermédiaire
Pour déterminer les nombres de moles des différentes espèces au cours de la transformation, on utilise
1'avancement x et les coefficients de l'équation chimique :
S’il disparaît 1 mole de C2H6O, il disparaît 3 moles de O2, il se forme 2 moles de C02 et 3 moles de H20.
S’il disparaît x moles de C2H6O, il disparaît ……… moles de O2, il apparaît …….. moles de CO2 et
………… moles de H20.
Remplir la 2e ligne du tableau.
2.3. État final
La réaction s'arrête quand un des réactifs est entièrement consommé : c'est le réactif limitant.
Pour le déterminer, il suffit d'écrire que le nombre de moles de chaque réactif est toujours 0.
(a) Déterminer l'avancement maximal et en déduire le réactif limitant.
………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………
L’avancement maximal est xmax = …………………
Le réactif limitant est donc ………………………...
(b) Remplir la dernière ligne du tableau.
(c) Calculer la masse molaire de l'eau et en déduire la masse d'eau obtenue.
……………………………………………………………………………………………………………………….
……………………………………………………………………………………………………………………….
(d) Calculer le volume de dioxyde de carbone obtenu.
…………………………………………………………………………………………………………………….....
……………………………………………………………………………………………………………………….

Exercice : combustion du méthanol
1. Quelle est la formule du méthanol ? Calculer sa masse molaire.
2. Écrire l'équation de la combustion complète du méthanol.
3. Calculer la masse de 1 mL de méthanol ; la densité du méthanol est d = 0; 78.
4. On fait brûler 1 mL de méthanol dans l'air ; calculer la masse d'eau obtenue.
__________________________________________________________________________________________
Exercice : combustion du méthanol
1. Quelle est la formule du méthanol ? Calculer sa masse molaire.
2. Écrire l'équation de la combustion complète du méthanol.
3. Calculer la masse de 1 mL de méthanol ; la densité du méthanol est d = 0; 78.
4. On fait brûler 1 mL de méthanol dans l'air ; calculer la masse d'eau obtenue.
Exercice : combustion du méthanol
1. Quelle est la formule du méthanol ? Calculer sa masse molaire.
2. Écrire l'équation de la combustion complète du méthanol.
3. Calculer la masse de 1 mL de méthanol ; la densité du méthanol est d = 0; 78.
4. On fait brûler 1 mL de méthanol dans l'air ; calculer la masse d'eau obtenue.
Exercice : combustion du méthanol
1. Quelle est la formule du méthanol ? Calculer sa masse molaire.
2. Écrire l'équation de la combustion complète du méthanol.
3. Calculer la masse de 1 mL de méthanol ; la densité du méthanol est d = 0; 78.
4. On fait brûler 1 mL de méthanol dans l'air ; calculer la masse d'eau obtenue.
__________________________________________________________________________________________
Exercice : combustion du méthanol
1. Quelle est la formule du méthanol ? Calculer sa masse molaire.
2. Écrire l'équation de la combustion complète du méthanol.
3. Calculer la masse de 1 mL de méthanol ; la densité du méthanol est d = 0; 78.
4. On fait brûler 1 mL de méthanol dans l'air ; calculer la masse d'eau obtenue.
__________________________________________________________________________________________
1
/
3
100%