Titrage redox : Exercice corrigé Fe2+ / MnO4-

Exercice d’entraînement : titrage d’oxydo-réduction
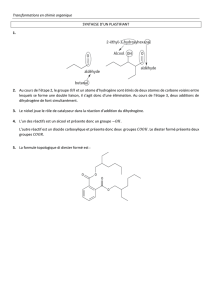
Dosage d’une solution de sulfate de fer II
On dose par titrage, en milieu acide, un volume V = 10,0 mL d’une solution de sulfate de fer II à
concentration c en ion Fe
2+
. Pour cela on utilise une solution de permanganate de potassium à
concentration molaire c’ = 0,020 mol.L-1 en ions permanganate MnO
4
-
.
Une coloration violette persiste quand on a ajouté V
E
= 10,5 mL de solution titrante.
1- Schématiser le montage expérimental.
2- Ecrire l’équation support du titrage.
3- Définir l’équivalence et préciser comment la détecter en pratique ;
4- Déterminer la concentration c en ions fer II de la solution de sulfate de fer II.
On donne : MnO
4
-
/Mn
2+
et Fe
3+
/Fe
2+
. Aux concentrations évoquées, les solutions de Fe
2+
sont vert-pâle et celle de Fe
3+
sont jaune orangée.
Dosage d’une solution de sulfate de fer II
Corrigé
1- Montage expérimental
Solution de permanganate de
potassium à concentration
c’ = 0,020 mol.L
-1
en ions permanganate MnO
4
–
( violet)
V = 10,0 mL de solution de sulfate de fer II
à concentration c en ion Fe
2+

2- Equation-support du titrage
La réaction de titrage implique les couples MnO
4
-
/Mn
2+
et Fe
3+
/Fe
2+
. D’après le protocole, les
espèces réactives sont MnO
4
–
et Fe
2+
.
Les demi-équations s’ écrivent donc :
MnO
4-
+ 8 H
+
+ 5 e
-
= Mn
2+
+ 4 H
2
O
Fe
2+
= Fe
3+
+ e- ( x 5 )
MnO
4-
+ 8 H
+
+ 5 Fe
2+
Mn
2+
+ 4 H
2
O + 5 Fe
3+
est l’équation du titrage .
3- Equivalence
L’équivalence sera atteinte lorsque les deux réactifs MnO
4
–
et Fe
2+
auront été apportés dans
les proportions stœchiométriques , ces réactifs seront alors limitants.
Initialement le contenu de l’erlenmeyer est vert pâle . On verse progressivement la solution de
permanganate de potassium de couleur violette . Avant l’équivalence les ions permanganate sont
limitants aussi ils sont consommés dès leur apport dans le mélange par des ions Fe
2+
qui
disparaissent en laissant place à des ions Fe
3+
. La solution va donc se colorer progressivement au
jaune orangée . A l’équivalence , tous les ions Fe
2+
ont été consommés par un nombre suffisant
d’ions MnO
4-
, L’ajout d’une goutte de solution de permanganate de potassium laissera des ions
MnO
4-
non consommés : aussi la solution se colorera en violet , l’emportant sur le jaune orangé de
la solution contenue dans le bécher . Ce changement de couleur permettra de repérer
l’équivalence.
4- Concentration c en ions fer II de la solution de sulfate de fer II.
Le tableau suivant permet de suivre l’évolution des quantités de matière durant le titrage . On
suivra uniquement l’évolution des quantités de matière des réactifs
Equation MnO
4
-
+ 8 H
+
+ 5 Fe
2+
Mn
2+
+ 4 H
2
O + 5 Fe
3+
Qtés de matière
Avancement
initial x= 0
c’ V
E
c V
Avancement à
l’équivalence
x = xeq
c’ V
E
– xeq
= 0
c V – 5 xeq
= 0
A l’équivalence on a donc simultanément c’ V
E
– xeq = 0 et c V – 5 xeq = 0
Donc xeq = c’ V
E
et xeq =
5
cV
soit c’ V
E
=
5
cV
Il vient
A.N. c =
10
5
10
02
0
5
,.,.
x
x
donc c = 0,105 mol.L
-1
La solution de sulfate de fer II est donc à concentration c = 0,105 mol.L
-1
en ions fer II .
c =
V
V
c'
5
E
1
/
2
100%