Exercice 1ère S : Etude d`une transformation chimique

Exercice 1ère S : Etude d’une transformation chimique
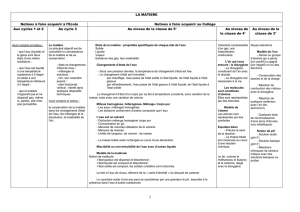
Le dioxygène O2(g) peut être préparé au laboratoire. Pour cela, il suffit de mélanger :
une solution aqueuse (notée S1) de permanganate de potassium (K+(aq) + MnO4-(aq) ) ,
une solution aqueuse (notée S2) d’eau oxygénée (H2O2 (l))
une solution aqueuse (notée S3) d’acide sulfurique (2 H+(aq) + SO42-(aq))
On donne ci-dessous, les concentrations molaires en soluté apporté de trois solutions, ainsi que
les volumes de solutions versés lors de cette transformation chimique :
Pour S1 : C1 = 0,10 mol.L-1 ; V1 = 13 mL
Pour S2 : C2 = 0,25 mol.L-1 ; V2 = 10 mL
Pour S3 : C3 = 6,0 mol.L-1 ; V3 = 2,0 mL
Le mélange est réalisé sous une pression de 1015 hPa et à la température de 25°C. Dans ces
conditions, le volume molaire d’un gaz vaut 24,4 L.mol-1
On suppose que le volume de la solution dans l’état final vaut 25 mL.
1) Recopier et compléter l’équation chimique de la réaction écrite ci-dessous :
2 MnO4-(aq) + 5 H2O2 (l) + ……H+(aq) 5 O2(g) + …….Mn2+(aq) + …….H2O(l)
2) Quels sont les réactifs, les produits et les espèces spectatrices de cette transformation ?
3) Déterminer les quantités de matière, à l’état initial :
a) des ions permanganate MnO4-(aq)
b) de l’eau oxygénée H2O2 (l) .
4) Dans cette transformation, les ions H+(aq) sont introduits en excès. Quel est donc le réactif
introduit en plus faible quantité ?
5) Construire le tableau d’avancement décrivant l’évolution du système chimique.
6) a) Quel est le réactif limitant ? Justifier.
b) Quelle est la valeur de l’avancement maximum ?
7) a) Déterminer la quantité de matière de dioxygène formé dans l’état final.
b) En déduire le volume de dioxygène formé dans l’état final.
8) Calculer la concentration molaire des ions Mn2+(aq) dans l’état final.

Exercice 1ère S : Etude d’une transformation chimique
Le dioxygène O2(g) peut être préparé au laboratoire. Pour cela, il suffit de mélanger :
une solution aqueuse (notée S1) de permanganate de potassium (K+(aq) + MnO4-(aq) ) ,
une solution aqueuse (notée S2) d’eau oxygénée (H2O2 (l))
une solution aqueuse (notée S3) d’acide sulfurique (2 H+(aq) + SO42-(aq))
On donne ci-dessous, les concentrations molaires en soluté apporté de trois solutions, ainsi que
les volumes de solutions versés lors de cette transformation chimique :
Pour S1 : C1 = 0,10 mol.L-1 ; V1 = 13 mL
Pour S2 : C2 = 0,25 mol.L-1 ; V2 = 10 mL
Pour S3 : C3 = 6,0 mol.L-1 ; V3 = 2,0 mL
Le mélange est réalisé sous une pression de 1015 hPa et à la température de 25°C. Dans ces
conditions, le volume molaire d’un gaz vaut 24,4 L.mol-1
On suppose que le volume de la solution dans l’état final vaut 25 mL.
1) Recopier et compléter l’équation chimique de la réaction écrite ci-dessous :
2 MnO4-(aq) + 5 H2O2 (l) + ……H+(aq) 5 O2(g) + …….Mn2+(aq) + …….H2O(l)
2) Quels sont les réactifs, les produits et les espèces spectatrices de cette transformation ?
3) Déterminer les quantités de matière, à l’état initial :
c) des ions permanganate MnO4-(aq)
d) de l’eau oxygénée H2O2 (l) .
4) Dans cette transformation, les ions H+(aq) sont introduits en excès. Quel est donc le réactif
introduit en plus faible quantité ?
5) Construire le tableau d’avancement décrivant l’évolution du système chimique.
6) a) Quel est le réactif limitant ? Justifier.
b) Quelle est la valeur de l’avancement maximum ?
7) a) Déterminer la quantité de matière de dioxygène formé dans l’état final.
b) En déduire le volume de dioxygène formé dans l’état final.
8) Calculer la concentration molaire des ions Mn2+(aq) dans l’état final.
1
/
2
100%