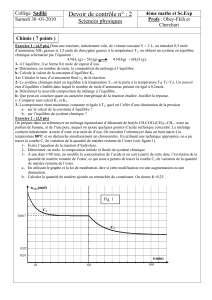
prérentrée L1 calculs en chimie 2010 [Mode de compatibilité]

1. conseils concernant les calculs
2. unités
4. symboles grecs et conventions d’écriture
3. homogénéité d’une équation
Pré-rentrée chimie
4. symboles grecs et conventions d’écriture
6. équation chimique
5. logarithme népérien (ln) et logarithme décimal (log)

7. calcul d’erreur
8. chiffres significatifs
10.
méthode des tangentes
Pré-rentrée chimie (suite)
9. molarité (M) et normalité (N)
11. Initiation au tableau périodique
12. Représentation de molécules dans l’espace
10.
méthode des tangentes

AH + H
2
0
A
-
+ H
3
O
+
1. Conseils concernant les calculs en chimie
Calcul du pH d’un acide faible de concentration
0,05 M et de constante d’équilibre Ka=1,78.10-5
Exemple 1
][][
3
AOH
K
−+ ×
=
AH + H
2
0
A
-
+ H
3
O
+
C0-h h h
][
3
AH
K
a
=
]0log[
3+
−= HpH
)log(
2
1
0
cpKapH −=
acide faible
KapKa log
−
=
réponse

AH + H20 A-+ H3O+
C0-h h h
1. Conseils concernant les calculs en chimie
Calcul du pH d’un acide faible de concentration
0,05 M et de constante d’équilibre Ka=1,78.10-5
Exemple 1
][ ][][ 3AH AOH
Ka
−+ ×
=
]
0
log[
+
−
=
H
pH
0
0
2
0
2
=−×− −×=
h)(cKh
h)(cKh
a
a
0
0
2=−− hKcKh aa
Pour trouver le pH…
Il faudrait résoudre un polynôme
du second degré
]
0
log[
3
+
−
=
H
pH
hc hh
K
o
a−
×
=
hpH log
−
=
(Démonstration simplifiée)
réponse

AH + H20 A-+ H3O+
C
0
-
h
h
h
1. Conseils concernant les calculs en chimie
Calcul du pH d’un acide faible de
concentration 0,05 M et de constante
d’équilibre Ka=1,78.10-5
- Savoir simplifier une somme par la
recherche de termes négligeables
Exemple 1
h
c
hh
K
a
−
×
=
C
0
-
h
h
h
]0log[
3+
−= HpH
h
c
K
a
−
=
0
L’acide est faible , donc faible dissociation: c0-h ≈
≈≈
≈c0
2
hcK
oa
≈×
)log(
2
1
0
cpKapH −=
(h est négligeable devant c0
dans cette différence)
réponse
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
1
/
48
100%