Évaluation du test (-2)proPSA combiné au PSA total et PSA libre

Journal Identification = ABC Article Identification = 0894 Date: September 30, 2013 Time: 2:24 pm
doi:10.1684/abc.2013.0894
537
Pour citer cet article : Lamy PJ, Montels F, Tosi D, Leizour B, Bascoul-Mollevi C, Castan F, Roques S, Nielloud F, Rebillard X. Évaluation du test (-2)proPSA combiné
au PSA total et PSA libre pour la détection précoce du cancer de la prostate. Ann Biol Clin 2013 ; 71(5) : 537-44 doi:10.1684/abc.2013.0894
Article original
Ann Biol Clin 2013 ; 71 (5) : 537-44
Évaluation du test (-2)proPSA combiné au PSA
total et PSA libre pour la détection précoce
du cancer de la prostate
Evaluation of (-2)proPSA in combination with total PSA and free PSA
for the early detection of prostate cancer
Pierre-Jean Lamy1
Frédéric Montels1
Diego Tosi2
Benoit Leizour3
Caroline Bascoul-Mollevi4
Florence Castan4
Sylvie Roques1
Fabien Nielloud1
Xavier Rebillard3
1Laboratoire de biologie spécialisée,
Institut régional du cancer de
Montpellier, France
<[email protected].fr>
2Service d’oncologie médicale, Institut
régional du cancer de Montpellier,
France
3Clinique Beausoleil, Montpellier,
France
4Service de biostatistique, Institut
régional du cancer, Montpellier, France
Article rec¸u le 22 mars 2013,
accept´
ele28ao
ˆ
ut 2013
Résumé. La validation analytique et clinique de nouveaux biomarqueurs
de détection précoce du cancer de la prostate est nécessaire. L’analyse du
(-2)proPSA adjoint aux valeurs du PSAT et du PSA libre standardisés permet de
calculer un index PHI relié à une probabilité plus forte de biopsie positive chez
des patients présentant des valeurs de PSA comprises dans la zone d’incertitude
de diagnostic de cancer, entre 3-4 et 10 ng/mL. Le but de cette étude est de
valider les performances analytiques du (-2)proPSA et de déterminer la valeur
prédictive de l’index PHI pour la détection précoce du cancer de la prostate.
Les performances analytiques du test (-2)proPSA sont suffisantes pour un usage
en clinique avec une sensibilité de 3,64 pg/mL et une gamme large permettant
d’éviter les dilutions. La stabilité de l’analyte est bonne jusqu’à au moins 3 h
à température ambiante avant centrifugation. L’étude des valeurs du PSAT, du
PSAL, du (-2)proPSA et de l’index PHI dans une population de patients consul-
tant pour un diagnostic précoce d’un cancer de la prostate montre que l’index
PHI est le marqueur prédictif de cancer le plus performant avec une aire sous
la courbe ROC de 0,70 alors qu’elle n’est seulement que de 0,56 pour le PSA
Total.
Mots clés : (-2)proPSA, index PHI, cancer de la prostate, PSA, marqueurs
tumoraux, détection
Abstract. The analytical and clinical validation of new biomarkers for the early
detection of prostate is necessary. (-2)proPSA, total PSA and free PSA values
are used to calculate a standardized PHI index linked to a higher probability
of a positive biopsy in patients with PSA levels between 3-4 and 10 ng/L,
the gray zone for prostate cancer diagnosis. The purpose of this study is to
validate the analytical performance of the (-2)proPSA and to determine the
predictive value of PHI for the early detection of prostate cancer. Analytical
performances are correct. It is not necessary to dilute samples before analysis.
The stability of (-2)proPSA is good until at least 3 hours at room temperature
before centrifugation. The study of the PSAT, PSAL, (-2)proPSA and PHI values
in a population of patients consulting for an early prostate cancer diagnosis
shows that the index PHI is the most powerful predictive marker of cancer with
an area under ROC curve of 0.70, whereas it is only 0.56 for total PSA.
Key words: (-2)proPSA, Phi index, prostate cancer, PSA, tumor markers, scree-
ning
Tirés à part : P.-J. Lamy
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.

Journal Identification = ABC Article Identification = 0894 Date: September 30, 2013 Time: 2:24 pm
538 Ann Biol Clin, vol. 71, n◦5, septembre-octobre 2013
Article original
Le cancer de la prostate (CaP) est responsable en Europe
de 50 000 décès par an, ce qui le place en tête de tous
les cancers en termes d’incidence et en seconde position
après le cancer du poumon en termes de mortalité. Le mar-
queur tumoral dans cette indication est l’antigène spécifique
de la prostate (PSA). Il a été identifié et purifié par Wang
et al. en 1979 [1]. Le PSA (prostate specific antigen) est
une sérine protéase qui est produite par les cellules épi-
théliales de la prostate, normales ou tumorales. Marqueur
irremplac¸able dans le suivi de la maladie, sa place dans le
dépistage est remise en question du fait d’une spécificité
faible [2, 3].
Le dépistage par le PSA pose deux problèmes. Le pre-
mier est la faible spécificité du PSA dans les valeurs
entre 4 et 10 ng/mL, due à des élévations modérées du
PSA en l’absence de cancer [4, 5]. Ces faux positifs
conduisent à prescrire en surnombre des recherches de
cancers par biopsie prostatique, intervention qui n’est pas
exempte d’effets iatrogènes [6]. Les risques de complica-
tions péri-opératoires, les problèmes à long terme tels que
l’incontinence urinaire et l’impuissance doivent être pris en
considération. Le deuxième problème est l’incapacité du
PSA à différencier les cancers agressifs des cancers indo-
lents ou à évolution lente [7]. Alors que tous les CaP vont
inévitablement progresser, beaucoup le font à un rythme
relativement lent sans conséquences cliniquement signifi-
catives. Le rapport bénéfice risque de la détection précoce
du CaP doit prendre en compte ces pronostics différents.
Ces deux limitations posent donc la question du surdiagnos-
tic (avec en particulier un risque de biopsies inutiles) et des
risques de surtraitement. Celui-ci pourrait en effet annuler
le bénéfice du diagnostic précoce tel qu’il a été démon-
tré dans l’étude European randomized study of screening
for prostate cancer (ERSPC). Cela a conduit les autorités
sanitaires à ne pas recommander de dépistage de masse
du CaP avec les tests actuels (PSA + toucher rectal [TR]).
En revanche, le diagnostic individuel précoce reste une
option possible à proposer aux patients [8]. La question
de la détection précoce demeure en effet pertinente, parti-
culièrement chez les patients à risque de cancers, dont on
sait qu’elle permet une prise en charge qui serait ineffi-
cace à un stade plus avancé de la maladie. Quoi qu’il en
soit, améliorer la spécificité des tests diagnostiques paraît
indispensable. L’autre enjeu majeur est de développer des
tests à forte valeur pronostique qui permettront de différen-
cier les patients porteurs de cancers à évolution lente des
patients porteurs de cancers agressifs. Il en résultera une
amélioration de la détection, une diminution des biopsies
inutiles et une prise en charge adaptée en fonction du risque
métastatique et du risque mortel du cancer détecté, allant
de la surveillance active à une prise en charge plus radicale
comme la prostatectomie.
De nombreuses approches ont été étudiées afin d’améliorer
le pouvoir discriminant du PSA : % PSA libre (% PSAL),
PSA complexé, densité du PSA, cinétique (vélocité, temps
de doublement). La multiplicité des tests de PSAT (PSAT)
et PSAL sur le marché, la standardisation du PSA, amé-
liorée, mais pas encore achevée, l’équimolarité entre PSAT
et libre indispensable pour le calcul du % de PSAL mais
rarement obtenue avec les kits les plus utilisés, la diversité
des méthodes de calcul de la cinétique du PSA, la difficulté
de mesurer de fac¸on reproductible le volume de la prostate
pour le calcul du PSA densité sont autant de raisons qui
expliquent l’absence de consensus sur l’utilisation de ces
tests dérivés.
D’autres marqueurs ont été ou sont en cours d’évaluation.
Parmi les plus avancés sur le plan de la validation on peut
citer le gène 3 spécifique au cancer de la prostate (PCA3) et
les gènes de fusion [9, 10]. Ces marqueurs moléculaires se
recherchent dans l’urine après un massage prostatique. La
famille des kallikréines, dont le PSA est l’un des membres,
et les précurseurs du PSA [11] offrent une approche intéres-
sante. Retrouvés dans le sang, ces marqueurs sont faciles à
analyser et reproductibles dans le temps.
Le PSA est une protéine issue de l’épissage alternatif d’un
ARN codé par le gène hKLK3. Cet ARN est d’abord tra-
duit en préproPSA de 261 acides aminés qui est clivé en
proPSA de 244 acides aminés dans sa partie N-terminale.
Le proPSA porte en position N-terminale une séquence
de 7 acides aminés (APLILSR) qui peut être clivée par
la trypsine et la kallikréine 2 (hK2) lors de la maturation
en PSA [12]. Lors de ce clivage, des formes tronquées du
PSA peuvent être produites : le (-5)proPSA constitué de la
forme primaire de proPSA avec 5 amino-acides, LILSR, le
(-4)proPSA, contenant ILSR et le (-2)proPSA, contenant
SR attachés à l’extrémité N-terminal du peptide pro-leader.
Les formes tronquées du PSA sont d’autant plus résis-
tantes à l’activation par hK2 ou la trypsine. Les formes
(-5,-7) pro PSA n’ont pas montré d’utilité en clinique [13].
En revanche, la forme (-2)proPSA a été la plus étudiée.
Elle représente la forme tronquée la plus présente dans
les tumeurs et ne pouvant être transformée, elle reste la
forme de proPSA la plus stable. Elle est aussi retrouvée
dans le sang en plus grande quantité lors de cancer [14].
Le (-2)proPSA a montré dans plusieurs études qu’il avait
une meilleure spécificité que le PSA pour la détection des
cellules cancéreuses dans les biopsies de patients présen-
tant un PSA sérique élevé (4-10 ng/mL) [14-17]. Il permet
d’optimiser l’évaluation du risque du CaP et de diminuer le
nombre de biopsies négatives [17-19].
Le PHI (prostate health index) est un index combinant dans
une même équation les valeurs du (-2)proPSA, du PSAL et
du PSAT) :
(-2proPSA/PSAL).√PSAT
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.

Journal Identification = ABC Article Identification = 0894 Date: September 30, 2013 Time: 2:24 pm
Ann Biol Clin, vol. 71, n◦5, septembre-octobre 2013 539
Performances du test (-2)proPSA
Le PHI a l’avantage de fournir une valeur unique obte-
nue par une simple prise de sang. Il permet de calculer
un score qui aide à déterminer le niveau de risque de CaP
chez un individu. Ce test a obtenu en juillet 2012 le label
« FDA-Cleared » pour une utilisation chez les hommes pré-
sentant une valeur de PSA comprise entre 4 et 10 ng/mL.
Le but de cette étude est d’évaluer les performances ana-
lytiques du test PHI développé par Beckman-Coulter pour
le dosage sérique du (-2)proPSA. La capacité du PSAT,
PSAL, (-2)proPSA et PHI à prédire un CaP (biopsie posi-
tive) a été étudiée chez 229 consultants pour une suspicion
de CaP.
Matériel et méthodes
Pour réaliser cette étude, des échantillons de sérum de
patients atteints d’un CaP, congelés à -80 ◦C, et issus de
la biothèque du laboratoire de biologie spécialisée et onco-
génétique de l’ICM (Montpellier, France) ont été utilisés.
Les dosages ont été réalisés sur l’automate Access avec
les kits Beckman (-2)proPSA Access Hybritech, PSAT,
fPSA) utilisant une technique immunoenzymatique de type
sandwich sur particules paramagnétiques avec une détec-
tion par chimiluminescence. Les volumes prélevés sont
25 L pour le PSAT et le PSAL et de 50 L pour
le (-2)proPSA. La calibration utilisée était la calibration
Hybritech.
La gamme de calibration réalisée par le fabricant com-
porte 7 standards de concentration 0 ; 6,13 ; 20,10 ; 49,10 ;
105,54 ; 491,90 et 4 802,60 pg/mL ; 3 contrôles sont fournis
par le fabricant : 0, 20,10 et 491,90 pg/mL.
La méthodologie d’évaluation a été adaptée des recomman-
dations du guide Cofrac LAB GTA 04. Après une période
de familiarisation du protocole suivi selon les recomman-
dations du fabricant, ont été évaluées :
– la limite de détection par la mesure répétée 30 fois du
standard 0 dans la même série, le calcul de la moyenne et
de l’écart type des mesures et définie par Ld=m+3s;
– la limite de quantification par des dilutions croissantes
du standard 20,10 pg/mL avec du diluant ; 6 dosages ont
été réalisés pour chaque dilution. L’écart type s et l’écart
de la moyenne«m»àlavaleur théorique ont été calculés
définissant le CV% comme égalàsx100/m. Le seuil de
quantification fut défini comme étant la valeur pour laquelle
le CV et/ou l’écart à la valeur théorique est supérieur à la
valeur pré-établie (20 %) ;
– la linéarité par dilution au 1/2, 1/4, 1/8, 1/16 et 1/32 des
sérums de patients, étude de la linéarité de la courbe de
dilution et calcul des % de récupération ;
– la fidélité (répétabilité, fidélité intermédiaire) par 10
dosages des sérums de contrôle dans la même manipula-
tion (répétabilité) et par leur dosage sur 4 manipulations
effectuées sur 4 jours. La fidélité est appréciée par le calcul
des moyennes et écarts types pour déterminer le coefficient
de variation ;
– l’influence des conditions de conservation du prélève-
ment mesurée par le dosage journalier de sérums provenant
de sang total centrifugé à réception du tube ou après 3 h
sur la paillasse (T◦ambiante) et de sérums avant et après 1
cycle de congélation-décongélation.
Une série de 117 patients présentant une valeur de PSA
comprise entre 4 et 10 ng/mL a été testée pour les valeurs
de (-2)proPSA, PSAL et PSAT afin de calculer l’index
PHI.
Sur une série de 553 patients consultant entre janvier 2010 et
décembre 2012 pour une suspicion de cancer de la prostate
dans l’unité d’urologie de la clinique Beausoleil (Montpel-
lier, France), un dosage PSAT, de PSAL et de (-2)proPSA
a été réalisé ; 229 patients ont été biopsiés afin de recher-
cher la présence de tissu tumoral prostatique. Les résultats
des marqueurs et du PHI ont été comparés avec les résul-
tats de la biopsie. Une courbe ROC (receiver operating
curve) a été réalisée pour chaque marqueur et le PHI afin
d’étudier leur capacité à prédire le résultat de la biopsie.
Les analyses statistiques ont été réalisées avec le logiciel
Stata 11 software (Stata Corporation, College Station, TX.
Tous les patients ont donné leur accord par un consente-
ment écrit. L’étude a été validée par le comité d’éthique
local (CORT).
Résultats et discussion
Limites de détection et de quantification
Le dosage du zéro donne un signal moyen de 6 471 RLU
avec un écart type de 109. La courbe reliant le signal à la
concentration entre le zéro et le premier standard a pour
équation : y(RLU) = 1261,7x-2197,9. Au point zéro plus
trois écarts types (signal Y = 6 471 + 327= 6 798 RLU),
la concentration X◦définissant la limite de détection est de
3,64 pg/mL. Le test d’évaluation du seuil de quantification
montre qu’aucune dilution du standard 2 (20,10 ng/mL) ne
présente de CV% supérieurà5%(tableau 1.) La limite de
quantification, encore parfois appelée seuil de sensibilité
fonctionnelle serait de 1,85 pg/mL. La limite de détec-
tion est définie statistiquement comme étant la plus petite
quantité distinguable du blanc. La limite de quantifica-
tion lui est normalement supérieure, mais on observe ici
qu’aucune dilution ne présente de CV >5 %. On pourra
retenir le seuil de 3,64 pg/mL comme limite pour le rendu de
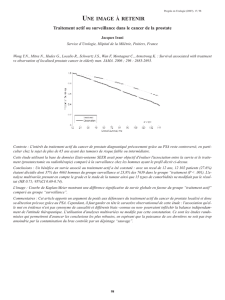
résultats. Dans une série de 117 patients ayant des valeurs
PSA comprises entre 4 et 10 ng/mL, la concentration de
(-2)proPSA variait entre 6,72 et 51,01 pg/mL (figure 1). Le
seuil de 3,64 pg/mL est inférieur aux valeurs trouvées chez
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.

Journal Identification = ABC Article Identification = 0894 Date: September 30, 2013 Time: 2:24 pm
540 Ann Biol Clin, vol. 71, n◦5, septembre-octobre 2013
Article original
Tableau 1. Étude de la limite de quantification étudiée par des dilutions croissantes d’un standard de valeur 20,10 pg/mL avec du diluant.
Standard à pg/mL + diluant (en %) 500 + 0 450 + 10 400 + 20 350 + 30 300 + 40 250 + 50
Moyenne 18,80 17,38 15,34 13,34 11,43 9,38
Écart type 0,49 0,25 0,31 0,46 0,30 0,13
CV% 2,63 1,46 2,02 3,44 2,64 1,41
Standard à pg/mL + diluant (en %) 200 + 300 150 + 350 100 + 400 50 + 450 0 + 500
Moyenne 8,35 5,78 3,74 1,85 0
Écart type 0,68 0,21 0,11 0,07 0,00
CV% 8,19 3,57 2,93 3,73 0,00
les patients. Il est donc parfaitement compatible avec les
concentrations habituellement retrouvées chez les patients
susceptibles de bénéficier de ce test, c’est-à-dire présentant
un PSA entre 4 et 10 ng/mL.
Évaluation de la répétabilité
et de la reproductibilité
Les CV issus du test de répétabilité pour des concentrations
de (-2)proPSA de 37 et 168 pg/mL sont respectivement de
9,1 et de 2,8 % (tableau 2). La fidélité intermédiaire testée
avec les mêmes sérums montre des CV% de 3,7 et 0,9 %.
Les CV pour le PSA T et le PSAL sont inférieursà5%pour
les tests de répétabilité et inférieursà7%pour les tests de
la fidélité intermédiaire.
Ainsi, pour les trois paramètres permettant de calculer
l’index PHI, les tests de reproductibilité et de fidélité inter-
médiaires présentent des CV% inférieurs à 10 %.
Évaluation de la stabilité
Pour les échantillons de patients utilisés dans ces tests, le
temps entre le prélèvement veineux et la prise en charge au
laboratoire était inférieurà2h(tableau 3).
La conservation de l’échantillon à température ambiante
au laboratoire avant centrifugation (sang total prélevé
0
0,00 0,50 1,00 1,50 2,00 2,50
20
40
60
80
100
120
ng/mL
PHI = f(PSAL)
y = -3,9336x + 46,428
R
2
= 0,0111
B
0
0,00 2,00 4,00 6,00 8,00 10,00 12,00
20
40
60
80
100
120
ng/mL
PHI = f(PSAT)
y = 2,3299x + 26,84
R
2
= 0,0652
A
0
0,00 10,00 20,00 30,00 40,00 50,00 60,00
20
40
60
80
100
120
pg/mL
PHI = f((-2)proPSA)
y = 1,0937x + 23,055
R
2
= 0,3384
C
Figure 1. Corrélation entre l’index PHI et ses composants chez 117 patients présentant un taux de PSA compris entre 4 et 10 ng/mL.
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.

Journal Identification = ABC Article Identification = 0894 Date: September 30, 2013 Time: 2:24 pm
Ann Biol Clin, vol. 71, n◦5, septembre-octobre 2013 541
Performances du test (-2)proPSA
Tableau 2. Étude de la répétabilité et de la fidélité intermédiaire.
-2proPSA (pg/mL) PSAT (ng/mL) PSAL (ng/mL)
Sérum 1 Sérum 2 Sérum 3 Sérum 1 Sérum 2 Sérum 3 Sérum 1 Sérum 2 Sérum 3
Répétabilité
Moyenne 36,45 159,33 165,27 10,39 20,57 18,62 1,00 1,10 2,86
Écart type 3,31 4,40 3,75 0,48 0,42 0,38 0,013 0,013 0,049
CV% 9,1 2,8 2,3 4,6 2,0 2,1 1,3 1,2 1,7
Fidélité intermédiaire
Moyenne 38,09 161,06 163,42 10,20 20,44 18,82 0,98 1,13 2,80
Écart type 0,04 0,39 2,40 0,59 0,87 0,95 0,007 0,071 0,057
CV% 0,1 0,2 1,5 5,8 4,3 5,1 0,7 6,3 2,0
Tableau 3. Influence des conditions de conservation.
Patient 1 : aliquot 1 Patient 1 : aliquot 2
Dosage extemporané 30,83
Après3hàtempérature ambiante 31,02 (+ 0,6 %)
Après congélation 29,85 (-3,2 %) 30,92 (-0,3 %)
Patient 2 : aliquot 1 Patient 2 : aliquot 2
Dosage extemporané 295.9
Après3hàtempérature ambiante 279,2 (-5,7 %)
Après congélation 328,9 (+11,1 %) 342,9 (+22.8 %)
Patient 3 : aliquot 1 Patient 3 : aliquot 2
Dosage extemporané 614.8
Après3hàtempérature ambiante 583,8 (-5 %)
Après congélation 631,3 (+2,7 %) 548,6 (-6.02)
Patient 4 : aliquot 1 Patient 4 : aliquot 2
Dosage extemporané 3 551
Après3hàtempérature ambiante 3 618 (+1,8 %)
Après congélation 3 372 (-5 %) 3 032 (-16,2 %)
Aliquots 1 et 2 issus du même prélèvement ; Aliquot 1 : sang total centrifugé à réception. Sérum dosé avant et après congélation ; Aliquot 2 : sang conservé
3 h à température ambiante puis centrifugé. Sérum dosé avant et après congélation.
sur tube sec) pendant 3 h influence très modérément le
dosage. Quelle que soit la concentration de (-2)proPSA,
les variations observées sont inférieures à 5,7 %, ce qui
est comparable au coefficient de variation observé en inter-
série (fidélité intermédiaire, voir tableau 2). On peut donc
conclure à une stabilité de l’analyte pendant au moins 3 h
dans le sang total conservé à température ambiante.
Les valeurs de -2pro-PSA varient de -5 à + 11,2 % avant et
après 1 cycle de congélation-décongélation pour les prélè-
vements centrifugés à réception au laboratoire. On observe
une plus grande variabilité (-11,2 ; +22,8 %) avant et après
un cycle de congélation-décongélation pour les prélève-
ments centrifugés après3hàtempérature ambiante sur la
paillasse.
Pour l’index PHI : la concentration de (-2)proPSA doit être
associée aux valeurs de PSA et PSAL. Le PSAT est stable à
température ambiante et 4 ◦C pendant quelques jours. Mais
le PSAL est labile à +4 ◦C [20]. Dans le cas de dosages dif-
férés, il n’est donc pas recommandé de conserver les sérums
pour l’évaluation l’index PHI à température ambiante ou à
+4 ◦C. La congélation à -20 ◦C d’un prélèvement rapide-
ment centrifugé est alors recommandée.
Évaluation de la linéarité (figure 2)
Quatre sérums de concentration 31,2, 38,9, 155,6 et
167 pg/mL ont été dilués dans le diluant du kit Hybritech
PSA (Ref 37200, Beckman Coulter). On note un léger
défaut de linéarité de l’épreuve de dilution pour ces 4 échan-
tillons dont les concentrations initiales sont incluses dans la
gamme. Les pourcentages de récupération sont tous supé-
rieurs à 100 % (m = 138 +/ 8,1 [121-148 %]. Ceci peut
être dû à un effet matrice et il conviendra d’être prudent sur
les valeurs obtenues par dilution d’un sérum. Toutefois, il
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.
 6
6
 7
7
 8
8
1
/
8
100%