1 Les Antithrombotiques

1
Les Antithrombotiques
Christine Mouton, Laboratoire d’Hématologie, Hôpital cardiologique du
Haut Lévêque. Pessac.
Historique des Anticoagulants
• Prescrits depuis plus de 50 ans, nbre de patients chirurgicaux sous antithrombotiques en
préopératoire pour MTEV ou pathologies cardiovasculaires
• Médicaments avec le défaut (risque hémorragique) de leur qualité (antithrombotique)
• Antithrombotiques :
Les Antiplaquettaires
Les Anticoagulants
Les anciens
HNF*
HBPM*
Orgaran®*
AVK**
Les anciens
HNF*
HBPM*
Orgaran®*
AVK**
Les récents
Hirudines
(Revasc®, Refludan®,
Angiox®)
Pentasaccaride
(Arixtra®,
idraparinux®)
Les récents
Hirudines
(Revasc®, Refludan®,
Angiox®)
Pentasaccaride
(Arixtra®,
idraparinux®)
Les nouveaux
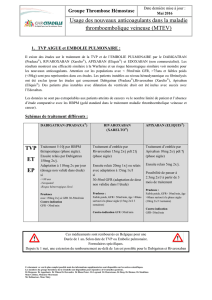
Dabigatran
(Pradaxa®)
Rivaroxaban
(Xarelto®)
Apixaban
Les nouveaux
Dabigatran
(Pradaxa®)
Rivaroxaban
(Xarelto®)
Apixaban
Voie parentérale
Origine animale Variabilité-risque
infectieux-Approvisionnement
**Intéractions
17000 hosptilisations
4500 décès
AntiIIa directs efficacité
thrombine libre + liée
AntiXa indirects aux AXa directs
Petites Molécules de synthèse
Exanta
Exanta
TIH
NON
TIH
NON
VO
VO
Leurs cibles
Phase initiation
Exposition Facteur Tissulaire lors
lésion vaisseau et activation FVII
(FVIIa)
Activation FX et génération faible
quantité de thrombine (IIa)
Phase amplification et
propagation
activation plaquettaire et facteurs
coagulation (Va et VIIIa XIa et Ixa)
Formation du cplxe prothrombinase
(FXa et FVa)
génération massive de thrombine
Formation du caillot de fibrine
Cibles des Anticoagulants
Apixaban Inhibiteurs
Facteur X
FXa
Xa inactif
Idraparinux
AVK Hirudines
Fibrine
FVII et X Dabigatran
Argatroban
Voie intrinsèque (contact)
bivalirudine/lépirudine/desirudine
Prothrombine
Fibrinogène
Inhibiteurs directs du Xa
Indirects du Xa et de la thrombine
Thrombine inactive
Thrombine IIa
indirects du Xa
Voie extrinséque (FT/FVIIa)
Inhibiteurs direct de la thrombine
Fondaparinux
Antithrombine
Rivaroxaban
Danaparoïde
HBPM et HNF

2
Héparine
• Structure Glycosaminoglycane
• Polysaccharide avec alternance de D-Glucosamine et d'acide
uronique, très fortement sulfaté (polyanion), extrait muqueuse de
porc
• hétérogène en taille moléculaire. On différencie en activité anti-
coagulante les chaînes < 18 saccharides et celle > 18.
• Relation structure activité
Héparine non fractionné
•Distribution
très large, glycoprotéines, PF4, fibronectine, facteur XIII , vWF,
macrophages cellules endothéliales. fixation non spécifique explique la
variabilité de la réponse à l’héparine et les phénomènes dits de
« résistance ». Cette distribution est très réduite avec les HBPM.
•Cinétique
saturation des sites protéiques et cellulaires (macrophages cellules
endothéliales) avec les fortes doses. T1/2 très courte et augmente ainsi
avec les fortes doses : de 30 min à 150 min (400UI/kg)
•Elimination
+++ dose dépendant saturable par fixation sur les protéines, cellules
endothéliales et macrophages (effet anticoagulant intensité et durée non
proportionnelle avec la dose ).
+/- rein
HBPM éliminées par le rein avec demi-vie d'élimination est plus longue
Site actif arginine
A T Xa A T Xa
P P
Site actif lysine
PM < 5400 Da PM > 5400 Da
P
Pentasaccharide
A T SA II a
Chaîne polysaccharidique
P 13 unités saccharidiques
Exosite 1
5 unités
Exosite 2
S A
Site actif
P A T SA II a
Mécanisme d ’action de l ’interaction
AT/héparine
INDICATIONS de l’HNF
• Indications cardiologiques: valves mécanique
• Embolie pulmonaire grave patient hémodynamiquement instable
• Situations à risque hémorragiques
• Insuffisance rénale/ HD/ HF
• Sujet âgé
•CEC
• locale (cathéters, chambres implantables)
2 formes
Sel sodique pour injection IV (à la seringue électrique)
Sel calcique pour injection sous cutanée
Effets secondaires
Thrombopénies induites à l’héparine (TIH)

3
HBPM
CLIVARINE (réviparine)
FRAGMINE (daltéparine)
FRAXIPARINE (nadroparine)
LOVENOX (énoxaparine)
1 injection
FRAXODI (nadroparine)
INNOHEP (tinzaparine)
Pharmacologie des HBPM : avantages cliniques
1/2 vie plus longue
bonne absorption SC
peu de liaisons aux constituants sanguins
2 injections SC/J en curatif
Moins de contrôles biologiques, mais :
-Plaquettes
-- fonction rénale +++ élimination rénale stricte risque d’accumulation si
clearance < 30mL/mn
Indications des HBPM
Prévention des accidents thromboemboliques veineux
•En milieu chirurgical
•En milieu médical
• Patient cancéreux HBPM de 3 à 6 mois de traitement forte recommandation
Traitement à la phase aiguë des accidents thrombotiques
•Veineux (relais AVK)
•Artériels (syndromes coronaires aigus, ischémie aiguë)
HBPM CI
•Absolues
Hypersensiblité (TIH, allergie)
Enfant moins 3 ans (alcool benzylique)
Accident hémorragique récent (intracérébral)
Insuffisance rénale (Cockroft <30mL/mn) (curatif)
•Relatives
AVC
Insuffisance rénale (Cockroft <30mL/mn) (préventif)
Anesthésie péridurale ou rachi
•Mises en garde
Patients hors normes
Risque de thrombopénie
Utilisation chez l’enfant
Prothèses valvulaires cardiaques
ARIXTRA® (fondaparinux, pentasaccharide)
• Pentassacharide synthétique
• Activité antiXa pure
• t1/2= 17h (21H sujet agé)
• SC en 1 injection Adaptée au poids (2.5 5 10 )
• Élimination rénale exclusive
• CI : Cl < 30
• Pas de TIH (mais surveillance plaquettes précaution)

4
M/S Volume 22, numéro 10, octobre 2006, p. 887-892 Cibles des médicaments
antithrombotiques Ludovic Drouet et Laurent Ripoll
Indications de l’ARIXTRA
Prévention
• MTEV en chirurgie orthopédique majeure du membre inférieur
• MTEV en chirurgie abdominale patients jugés à haut risque
• MTEV patient à haut risque alité pour une affection médicale
aiguë telle que insuffisance cardiaque et/ou trouble respiratoire
aigu, et/ou maladie infectieuse ou inflammatoire aiguës
Traitement
• TVP EP phase aiguës sauf patients hémodynamiquement
instables ou nécessitant une thrombolyse ou une embolectomie
pulmonaire
La surveillance biologique
HNF
• Réponse attendue à une dose adaptée (bolus IV 50 à 80 UI/kg, perfusion continue
400 à 600 UI/kg/j) =
Cible : ratio TCA 2 à 3 à la 6ème heure
et/ou activité antiXa entre 0.3 et 0.6 UI/ml
∆! Syndromes inflammatoires, poids inhabituel, augmentation doses
HBPM
• Pas de surveillance de l’effet biologique
• Sauf poids >> cas particuliers
• Mesure de activité antiXa au pic ou en résiduel si risque d’accumulation (IR, poids)
• 2 injections pic 3 à 4 h en 1 injection 4 à 6 h
Arixtra
• Pas de surveillance de l’effet biologique
• Mesure de Activité antiXa en résiduel (chirurgie, risque accumulation ?)
• Aucune TIH décrite, mais génération d’AC anti PF4-héparine possible
Surveillance des plaquettes
Reste inchangée :
pour prévention dans contexte post-opératoire ou traumatique
(plâtre, entorse…) lettre de mise au point 2010 AFSSAPS
pour HNF SC ou IV
pour ttt HBPM avec ttt HNF préalable
en cas épisode TE veineux ou artériel, lésion cutanée au site
injection et manifestation anaphylactoïde après injection HNF IV
faisant suite à ttt HNF 3 à 6 mois avant
numération plaquettaire avant traitement puis 2 fois/sem pendant 21 j
puis 1 fois/sem
Allégée en prévention médicale et lors traitement de la MTEV pour
HBPM AFSSAPS 2009
période traitement courte <10 j
faible risque associé aux HBPM
très faible risque pour Arixtra

5
1- Orgaran(Danaparoïde)
• Héparinoïde: héparane sulfate (80%), dermatane sulfate (10%), chondroitine
sulfate (10%)
• Activité anti Xa/anti IIa = 25
• Demi vie : 25h - Elimination rénale
• AMM : TIH avec ou sans complication TE
• Posologie
– curative
• dose de charge : bolus de 1250 à 3750 U en fonction du Pds
• dose d’entretien IV : 400 U/h pendant 4h
puis 300U/h pendant 4h
puis 150 à 200 U/h
Ou 2 injections en SC (pds)
– préventive SC : 750 U x 3/j si < 90kg 1250 U x 3/j si > 90 kg
• Surveillance biologique:
– numération plaquettaire quotidienne (remontée plaquettes < 3-4j)
– anti Xa adaptée à l’Orgaran (0.4 et < 0.7 UI/ml)
Médicaments de substitution aux héparines 2- Refludan(Lépirudine)
• Hirudine recombinante , inhibiteur direct de la thrombine
• Action indépendante AT
• Demi vie courte : 2 à 3 h - Elimination rénale
• AMM : TIH avec complications TE
• Posologie :
•Ne plus prescrire de bolus
• perfusion : 0.10 mg/kg/h à 0.15 mg/Kg/h
• Surveillance biologique :
• TCA : Ratio entre 1.5 à 2.5 ( problème de plafonnement)
• Temps d’Ecarine : adapté aux fortes doses mais difficile à
standardiser
• Hirudinémie : activité anti II a chromogénie
• Durée TTT < 12 j car apparition d’Ac anti hirudine entraînant
potentialisation de l’effet anticoagulant.
3 Argatroban (ARGANOVA®)
Anti thrombine direct
Données produit Perfusion IV, 2 microg/kg par min si atteinte hépatique
(Child-Pugh B), débuter à 0,5 microg/kg par min
• 1er contrôle TCA à 2h: cible TCA: 1,5 à 3 x témoin
• Pas d’antidote, mais effet réversible et demi-vie d’élimination = 52 min
• Relais AVK = période délicate; stop argatroban lorsque INR > 4 et
vérification de l’INR 4h plus tard (INR autour de 2,0 – 2,5)
• Perturbation de nbreux tests de coagulation (TCA, TQ mais aussi
dosage du fibrinogène, des facteurs de coagulation et des inhibiteurs)
- TCA souvent très long au 1er contrôle nécessité de réduire les
doses
•Consensus ACCP 2008
« when argatroban is used to treat patients who have heart failure, multiple
organ system, or severe anasarca or who are postcardiac surgery, we
suggest beginning the initial infusion at a rate between 0,5 and 1,2 microg/kg
par min …»
Les nouveaux anticoagulants : dabigatran,
rivaroxaban, apixaban
• Petites molécules
• Action directe et réversible sur cibles spécifiques
• Anti IIa :
– inactivation thrombine libre et liée au thrombus
•Anti Xa:
– FX positionné à la convergence des voies extrinsèque et
intrinsèque : régulation génération de thrombine
– Inhibition du FXa dans complexe prothrombinase
• Propriétés pharmacodynamiques prédictibles permettant :
– Dose fixe 1 à 2 fois/jour
– Pas de surveillance biologique
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%