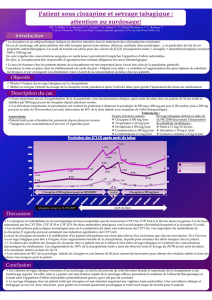
1er cas clinique - Service Central d`Authentification Université de

UNIVERSITE DE NANTES
________
FACULTE DE MEDECINE
________
Année 2004 N°117
THESE
pour le
DIPLOME D’ETAT DE DOCTEUR EN MEDECINE
Qualification en PSYCHIATRIE
par
David ALLENDER
né le 28 octobre 1976 à Sainte Catherine les Arras
________
Présentée et soutenue publiquement le 21 septembre 2004
________
ACTUALITE DE LA CLOZAPINE DANS LA PRISE EN CHARGE DU
PATIENT SCHIZOPHRENE
________
Président : Monsieur le Professeur J.-M. VANELLE
Directeur de thèse : Monsieur le Professeur J.-M. VANELLE
1

INTRODUCTION – CAS CLINIQUES ...........................................................6
1ER CAS CLINIQUE : MME A..................................................................................9
2EME CAS CLINIQUE : MME B............................................................................17
INDICATIONS, CONCEPT DE SCHIZOPHRENIE RESISTANTE........33
I. INTOLERANCE AUX NEUROLEPTIQUES.............................................................34
II. SYMPTOMES PSYCHOTIQUES ET PARKINSON..................................................35
III. SCHIZOPHRENIES RESISTANTES....................................................................37
1) Evolution du concept.................................................................................37
a) Critères de Kane................................................................................39
b) Critères initiaux du dictionnaire Vidal. ............................................40
c) Les 6 niveaux de réponse de May et Dencker..................................41
d) Les 7 niveaux de réponse de Brenner et Dencker. ...........................43
e) Continuum de réponse thérapeutique et approche
multidimensionnelle de Meltzer.................................................................45
2) Difficultés d’élaboration et limites d’utilisation d’une définition objective
applicable en pratique clinique.....................................................................46
3) Nouvelle formulation de l’indication de la clozapine par le dictionnaire
Vidal...............................................................................................................48
4) Données de la littérature concernant la schizophrénie résistante. ..........51
GENERALITES................................................................................................53
I. ASPECTS HISTORIQUES...................................................................................54
1) L’avènement des neuroleptiques...............................................................54
2) Histoire de la clozapine. ...........................................................................59
a) La découverte du produit : de la synthèse chimique (1959) à 1988. 59
b) De 1988 à nos jours : la redécouverte de la clozapine. ....................60
II. NEUROLEPTIQUES, ANTIPSYCHOTIQUES ET ATYPICITE...................................62
2

III. PHARMACOLOGIE.........................................................................................66
1) Structure chimique. ...................................................................................66
a) Famille des dibenzo-azépines...........................................................66
b) La clozapine......................................................................................67
2) Pharmacocinétique....................................................................................68
a) Résorption.........................................................................................68
b) Distribution.......................................................................................69
c) Métabolisme et élimination...............................................................69
d) Facteurs influençant la concentration plasmatique...........................70
3) Eléments de psychopharmacologie...........................................................71
a) La voie mésolimbique et l’hypothèse dopaminergique des signes
positifs.........................................................................................................71
b) La voie mésocorticale.......................................................................72
c) La voie nigro-striée...........................................................................72
d) La voie tubero-infundibulaire...........................................................73
e) Impact des neuroleptiques.................................................................74
4) Psychopharmacologie de la clozapine......................................................75
a) Impact de la clozapine sur le système dopaminergique....................75
b) Impact de la clozapine sur le système sérotoninergique. .................78
c) Clozapine et système noradrénergique. ...........................................80
d) Clozapine et système cholinergique muscarinique...........................82
e) Clozapine et système glutamatergique. ............................................82
f) Clozapine et système GABAergique.................................................83
EFFETS CLINIQUES DE LA CLOZAPINE................................................85
I. EFFETS DE LA CLOZAPINE SUR LES SYMPTOMES PSYCHOTIQUES.....................86
1) Efficacité de la clozapine chez les patients résistants aux traitements.....87
2) Durée adéquate d’une séquence d’essai par clozapine............................93
3) Posologies adéquates d’une séquence d’essai par clozapine...................95
3

4) Profil d’action de la clozapine..................................................................97
5) Conséquences de l’arrêt brutal du traitement. .........................................99
6) Effets à long terme...................................................................................101
7) Facteurs prédictifs de réponse au traitement. ........................................103
8) Effets de la clozapine sur les symptômes négatifs...................................104
a) Aspects historiques. ........................................................................104
b) Aspects actuels................................................................................106
c) Effets de la clozapine sur les symptômes négatifs..........................107
9) Clozapine et troubles cognitifs de la schizophrénie. ..............................112
a) Anomalies cognitives dans la schizophrénie..................................113
b) Effets de la clozapine sur les troubles cognitifs de la schizophrénie.
...................................................................................................................116
II. AUTRES PERSPECTIVES CLINIQUES..............................................................117
1) Schizophrénie et suicidalité.....................................................................118
a) Introduction.....................................................................................118
b) Données épidémiologiques.............................................................120
c) Effets de clozapine..........................................................................122
2) Schizophrénie et troubles thymiques.......................................................129
a) Introduction.....................................................................................129
b) Aspects nosgraphiques....................................................................131
c) Intérêts de la clozapine dans les troubles schizoaffectifs. ..............135
3) Conduites agressives...............................................................................144
a) Introduction.....................................................................................144
b) Conduites agressives et pathologie mentale...................................147
c) Intérêt de la clozapine dans les conduites agressives du patient
schizophrène. ............................................................................................150
4) Clozapine et dyskinésies tardives............................................................157
a) Généralités. .....................................................................................157
b) Effets de la clozapine sur les dyskinésies tardives.........................161
4

EFFETS SECONDAIRES MAJEURS DE LA CLOZAPINE ...................165
I. AGRANULOCYTOSE ET CLOZAPINE..........................................................167
II. ARRETS CARDIORESPIRATOIRES..............................................................169
III. CONVULSIONS ET CLOZAPINE..................................................................169
IV. MYOCARDIOPATHIE SOUS CLOZAPINE.....................................................171
V. SYNDROME MALIN DES NEUROLEPTIQUES...............................................171
CONCLUSION................................................................................................172
BIBLIOGRAPHIE..........................................................................................177
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
1
/
189
100%