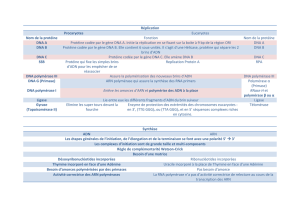
2) La méthylation de l`ADN

T
TH
HÈ
ÈS
SE
E
En vue de l'obtention du
D
DO
OC
CT
TO
OR
RA
AT
T
D
DE
E
L
L’
’U
UN
NI
IV
VE
ER
RS
SI
IT
TÉ
É
D
DE
E
T
TO
OU
UL
LO
OU
US
SE
E
Délivré par
l'Université
Toulouse III
-
Paul Sabatier
Discipline ou spécialité : Physiopathologie
JURY
Pr Claude Knauf - Président (I2MC - Université de Toulouse)
Pr Gilles Salbert - Rapporteur (Université de Rennes)
Dr Pierre-François Cartron - Rapporteur (Université de Nantes)
Dr Paola Arimondo - Examinatrice invitée (ETAC CNRS-Pierre Fabres)
Dr Jérôme Torrisani - Co-Directeur de thèse
Pr Louis Buscail - Directeur de thèse
Ecole doctorale :
Biologie Santé Biotechnologies
Unité de recherche : CRCT, UMR 1037 INSERM-UPS
Directeur(s) de Thèse : Pr Louis Buscail / Dr Jérôme Torrisani
Rapporteurs : Pr Gilles Salbert, Dr Pierre-François Cartron
Présentée et soutenue par Yannick DELPU
Le 4 octobre 2013
Titre : Méthylation de l'ADN et expression des microARNs dans la carcinogénèse
pancréatique

2
Résumé
Le cancer du pancréas est la quatrième cause de décès par cancer dans les pays
occidentaux. Son pronostic sombre est principalement dû à un diagnostic tardif et un
manque de traitements efficaces. À ce jour, l'amélioration de la détection et le
développement de nouvelles thérapies constituent les principales pistes pour une
meilleure prise en charge du cancer du pancréas. Le développement de ce cancer
implique des changements dans les profils de méthylation de l'ADN. Ces
changements conduisent à la réactivation de séquences normalement réprimées et à
la répression de gènes suppresseurs de tumeurs. Dans différents cancers, il a été
décrit la surexpression précoce des enzymes responsables de la méthylation de
l'ADN : les méthyltransférases de l’ADN. Cependant, le rôle exact joué par ces
protéines et les conséquences exactes de la méthylation de l'ADN dans la
carcinogénèse restent à être prouvés.
Lors de nos travaux, nous avons d'abord cherché à déterminer l'évolution des profils
de méthylation de l'ADN à travers l'étude de l'expression d'un microARN particulier:
miR-148a. Ce microARN est réprimé dans plusieurs cancers, ce qui suggère un rôle
suppresseur de tumeur. Nous avons confirmé la répression de miR-148a par la
méthylation de l'ADN dans plusieurs lignées cellulaires dérivées de cancer du
pancréas ainsi que dans des échantillons de tumeurs humaines, et nous avons
montré l'utilité de cette marque pour le diagnostic différentiel entre cancer du
pancréas et pancréatite chronique. De plus, la répression précoce de miR-148a
suggère très fortement le rôle suppresseur de tumeur de ce microARN, au moins
dans un contexte pancréatique. Nous avons alors évalué le potentiel thérapeutique
de miR-148a en rétablissant son expression dans des lignées cellulaires dérivées de
cancer du pancréas ainsi que dans un modèle de tumeurs préétablies chez la souris,
par transfert de gènes in vivo. Nous n’avons observé aucun changement significatif
dans le comportement des cellules/tumeurs surexprimant miR-148a. Ceci indique
que sa répression est une altération mineure accompagnant la cancérogenèse plutôt
qu'un phénomène crucial du développement tumoral. Comme la surexpression des
méthyltransférases de l'ADN et la méthylation de l'ADN sont deux évènements
précoces de la carcinogénèse pancréatique, nous avons élargi notre étude pour
déterminer si la seule surexpression de méthyltransférases de l'ADN est capable de
transformer des cellules pancréatiques normales. Nous avons observé que la
surexpression stable de ces protéines affecte considérablement le comportement
des cellules en ce qui concerne la prolifération cellulaire et la clonogénicité in vitro,
ainsi que leur profil de méthylation et d'expression génique. De manière intéressante,
ces lignées cellulaires ne sont pas capables d’induire la formation de tumeurs in vivo.
Ainsi, malgré la nécessité de valider ces résultats, ceux-ci suggèrent fortement que la
méthylation de l'ADN facilite la carcinogénèse, mais n'est pas suffisante pour
déclencher la formation de tumeurs.
Ces travaux contribuent à une meilleure compréhension de la carcinogénèse
pancréatique, et plus précisément, du rôle joué par la méthylation de l'ADN. De plus,
nos résultats récents sur les profils de méthylation de l'ADN et l'expression des
gènes en réponse à la surexpression des méthyltransférases de l'ADN ouvrent de
nouveaux horizons pour la recherche des cibles spécifiques de ces enzymes et le
rôle potentiellement oncogène de la méthylation de l'ADN.

3
« Si vous pensez avoir des problèmes en mathématiques, sachez que les miens sont
bien pires »
Albert Einstein (1879-1955), Prix Nobel de physique

4
Remerciements
Je remercie Pierre Cordelier, Jérôme Torrisani et Louis Buscail de m’avoir accueilli
dans leur équipe durant ces années. Leur investissement, leur patience (grande
patience …) et leur encadrement m’ont permis de me construire et de savoir
comment chercher mon chemin. Durant leur formation, ils m’ont poussé à acquérir
une certaine autonomie et à me confronter au mieux au monde scientifique qui
m’attend, que ce soit au niveau de la paillasse que de l’écriture. J’ai beaucoup
apprécié de pouvoir solliciter à la fois Jérôme et Pierre, deux faces d’une même
pièce qui dans leurs deux visions de la recherche, m’ont appris plus que ce que je ne
pouvais espérer. Pour tout cela, merci.
J’ai pu durant toutes ces années côtoyer les autres membres de l’équipe, Naïma,
Hubert, Marlène, Aline, Janick et Marion dont l’entrain, la bonne humeur et les
encouragements ont été d’une grande aide. Merci à vous aussi.
Merci aussi à tous mes compagnons de recherche, bien que l’expression des
sentiments que je vous porte n’aurait pas sa place en ce début de manuscrit. Je vous
renvoie donc, aux dernières pages de ces travaux.
Je tiens enfin à remercier mes deux rapporteurs, Gilles Salbert et Pierre-François
Cartron qui ont accepté d’évaluer ces travaux et dont l’analyse critique sera très
précieuse pour moi. J’espère être à la hauteur de vos attentes.
Je finirai en remerciant le Pr Claude Knauf qui a accepté, en dépit d’un délai très
court, de présider ce jury de thèse.

5
Table des matières
I. La régulation épigénétique de l’expression génique : de la physiologie … ..................... 9
1) Les différents processus épigénétiques ...................................................................... 9
2) La méthylation de l’ADN ............................................................................................15
a) Principe général .....................................................................................................15
b) Les méthyltransférases de l’ADN ...........................................................................18
c) La méthylation de l’ADN : de la mise en place … ...................................................19
d) La méthylation de l’ADN : au maintien des marques de méthylation dans le génome
23
e) Un modèle à décompartimenter ? ..........................................................................25
f) Les enzymes reconnaissant les marques de méthylation .......................................26
g) La méthylation de l’ADN dans les processus physiologiques .................................34
h) La méthylation de l’ADN : un mécanisme de répression uniquement ? ..................40
3) Les microARNs ..........................................................................................................42
i) La biogénèse et le mécanisme d’action des microARNs ........................................42
j) Régulation de l’expression des microARNs par méthylation de l’ADN ....................47
k) Régulation de la méthylation de l’ADN par les microARNs .....................................48
II. La régulation épigénétique de l’expression génique : la physiopathologie .....................50
1) Bouleversement des patrons de méthylation dans le cancer ......................................54
2) Altération de l’expression des DNMTs dans le cancer ...............................................56
3) La méthylation de l’ADN, une marque associée au cancer ........................................57
a) Les gènes hyperméthylés dans le cancer ...............................................................58
b) Les gènes hypométhylés dans le cancer ...............................................................59
c) La méthylation de l’ADN pour le diagnostic du cancer ............................................60
4) Les microARNs, acteurs de la carcinogénèse ............................................................62
III. La carcinogénèse pancréatique .................................................................................64
1) Les lésions prénéoplasiques du pancréas .................................................................64
2) Altérations épigénétiques des lésions prénéoplasiques du pancréas .........................69
3) Altérations de l’expression des microARNs dans le cancer du pancréas ...................71
IV. Résultats expérimentaux ...........................................................................................74
Article 1 - « La répression de l’expression de miR-148a par hyperméthylation de l’ADN est
un évènement précoce de la carcinogénèse pancréatique ». ............................................74
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
 192
192
 193
193
 194
194
 195
195
 196
196
 197
197
 198
198
 199
199
 200
200
 201
201
 202
202
 203
203
 204
204
 205
205
 206
206
 207
207
 208
208
 209
209
 210
210
 211
211
 212
212
 213
213
 214
214
 215
215
 216
216
 217
217
 218
218
 219
219
 220
220
 221
221
 222
222
 223
223
 224
224
 225
225
 226
226
 227
227
 228
228
 229
229
 230
230
 231
231
 232
232
 233
233
 234
234
 235
235
 236
236
 237
237
 238
238
 239
239
 240
240
 241
241
 242
242
1
/
242
100%