Le présent fichier est une publication en ligne reçue en

Le présent fichier est une publication en ligne reçue en dépôt légal, convertie en format PDF et
archivée par Bibliothèque et Archives nationales du Québec. L’information contenue dans le
fichier peut donc être périmée et certains liens externes peuvent être inactifs.
Version visionnée sur le site Internet d’origine le 11 novembre 2015.
Section du dépôt légal

© APES tous droits réservés Pharmactuel 2015;48(1) 5
ÉDITORIAL
Pour toute correspondance : Julie Méthot, Institut universitaire de cardiologie et de pneumologie de Québec, 2725, chemin Sainte-Foy, Québec (Québec) G1V 4G5, CANADA;
Téléphone : 418 656-8711, poste 2947; Télécopieur : 418 656-4656; Courriel : [email protected]
Vision de Pharmactuel
Julie Méthot1,2,3, B.Pharm., Ph.D., Louise Mallet4,5,6, B.Sc.Pharm., Pharm.D., CGP, FESCP
1Pharmacienne, Institut universitaire de cardiologie et de pneumologie de Québec, Québec (Québec) Canada;
2Professeure adjointe, Faculté de pharmacie, Université Laval, Québec (Québec) Canada;
3Rédactrice en chef, Pharmactuel, Montréal (Québec) Canada;
4Professeure titulaire de clinique, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
5Pharmacienne, Centre universitaire de santé McGill, Montréal (Québec) Canada;
6Rédactrice adjointe, Pharmactuel, Montréal (Québec) Canada
Reçu le 3 février 2015; Accepté après révision le 25 février 2015
Le comité de rédaction de Pharmactuel tient à vous
souhaiter ses meilleurs vœux pour l’année 2015. Étant
jeune nous ne comprenions pas pourquoi nos aînés
souhaitaient « la santé » lors de vœux du nouvel an. Avec
le temps et l’expérience, nous avons été témoin d’un ami,
d’un collègue, d’un parent ou d’un patient « injustement »
atteint d’une maladie qui a perturbé la quiétude du
quotidien. Notre souhait tout en sagesse : Que la santé et
la prospérité soient présentes tout au long de cette année.
Nous profitons aussi de ce moment pour remercier les
membres du comité de rédaction qui ont su, encore une
fois, relever le défi de la gestion éditoriale des articles
avec l’objectif ultime de publier des articles d’intérêt et
rigoureux. La tâche est importante pour faire avancer la
culture de publication au Québec.
Nous tenons à remercier les réviseurs, qui ont été cette
année pour la majorité des pharmaciens, des médecins,
des chercheurs ou d’autres professionnels de la santé qui
se sont investis dans le processus de révision par les pairs.
Une année nouvelle est aussi le temps de revoir ses
objectifs et de refaire son plan d’action tant sur l’aspect
professionnel que personnel. Cette année sera une année
charnière. Pharmactuel s’associe à l’équipe de Multimed
pour la mise en ligne du journal ainsi que différentes étapes
du processus éditorial. Pharmactuel constitue leur premier
partenaire francophone. Ce changement permettra une
gestion centralisée des articles et une prise en charge de
la révision linguistique et de la mise en forme des articles.
Les plus vieux (pas tant que ça) se rappelleront que nous
soumettions nos résumés et article par disquette dans les
années 90 et le tout était envoyé par la poste…. Oui, il existe
encore des dinosaures qui se souviennent…
Nous poursuivons notre engagement envers notre lectorat
francophone tant québécois qu’international. Au cours
des dernières années, un à deux articles de l’international
ont été publiés dans chacun des numéros de Pharmactuel.
Nos statistiques web rapportent près de 15 600 visites en
2014. La distribution par pays des sessions consultées est
la suivante : Canada (73 %), France (15 %), Suisse (3 %),
Belgique (2 %), Algérie (2 %), États-Unis (1 %), Maroc (1 %),
Brésil (1 %), Allemagne (1 %) et Tunisie (1 %), confirmant
notre lectorat international.
La force de Pharmactuel, sa disponibilité en ligne à tous
incluant ses archives, demeurera en 2015. Pharmactuel
poursuit sa mission de publier des œuvres originales et
novatrices destinées à la pratique pharmaceutique en
établissement de santé dans la francophonie. Pharmactuel
jouit d’une tribune internationale. Le processus de
révision par les pairs est bien en place pour les chroniques
Recherche, Pharmacothérapie, Cas clinique en direct de
l’unité et Évaluation critique d’un article scientifique. Notre
objectif de déposer notre dossier pour indexation Medline
est bien présent.
Pourquoi publier? Voici un bon coup réalisé par Mme
Sylvie Carle. À la suite de la publication d’un article « Les
antifongiques dans le traitement des infections invasives »,
elle a été contacté par un patient « désespéré » qui souffrait
d’un problème de santé grave et voulait connaitre son avis
sur le traitement à suivre1,2. Mme Carle l’a mis en contact avec
les spécialistes dans le domaine du Centre universitaire de
santé McGill, ce qui a sauvé la vie de ce patient. Ce patient
avait retracé l’article de Sylvie paru dans Pharmactuel et
disponible en ligne à tous, ce qui a permis de l’orienter
afin de personnaliser et d’optimiser son traitement. Il est
intéressant de constater le chemin parcouru par cet article,
qui avait d’ailleurs permis à Mme Carle de remporter le prix
du meilleur article de Pharmactuel Novopharm/Mayne
Pharma – A.P.E.S. en 20033.
Former la relève fait aussi partie de notre mission. Des
membres du comité de rédaction s’engagent dans des
cours de deuxième cycle au programme de Maîtrise en
pharmacothérapie avancée de l’Université de Montréal et
de l’Université Laval. On retrouve parmi les objectifs de
ces cours : favoriser le développement d’une culture de
l’écriture scientifique et leur faire vivre une expérience de
rédaction aux résidents4. Respectivement, Julie Méthot et
Louise Mallet sont responsables de ces cours à la faculté
de Pharmacie de l’Université Laval et celle de l’Université
de Montréal. Au cours des dernières années Roxane
Therrien, ancienne rédactrice associée, Christine Hamel,
rédactrice adjointe, Vincent Leclerc, rédacteur associé,

6 Pharmactuel 2015;48(1) © APES tous droits réservés
Financement
Aucun financement en relation avec le présent article n’a été
déclaré par les auteurs.
Conflits d’intérêts
Les auteurs ont rempli et soumis le formulaire de l’ICMJE
pour la divulgation de conflits d’intérêts potentiels. Les
auteurs n’ont déclaré aucun conflit d’intérêts en relation
avec le présent article.
Autorisation
Une autorisation écrite a été obtenue des personnes citées
dans le présent article.
ainsi que les auteurs du présent éditorial ont collaboré
soit à la prestation de cours ou à la première évaluation
des articles des résidents. L’engagement des membres du
comité a permis aux étudiants de vivre une expérience de
rédaction et de révision par les pairs. À Montréal, depuis
2011, l’engagement des membres du comité a permis à
deux cohortes d’étudiants (n = 65) de rédiger 24 articles
dans cinq revues scientifiques différentes. L’expérience de
mentorat en matière de publication a été partagée au niveau
provincial, national et international5-7. La tribune offerte
par ces cours permet d’aller de l’avant pour développer une
culture d’écriture auprès de la relève.
À l’amorce de l’année 2015, l’équipe de rédaction de
Pharmactuel souhaite à son lectorat une année épanouie
d’un point de vue personnel et professionnel. En souhaitant
recevoir vos articles pour publication au cours des
prochains mois….
1. Carle S. Les antifongiques dans le traitement
des infections invasives. Pharmactuel 2003;
36:25-41.
2. Centre universitaire de santé McGill. Infection
inexplicable : du laboratoire au chevet des patients.
[en ligne] http://cusm.ca/newsroom/ article/
infection-inexplicable-du-laboratoire-au-
chevet-patients (site visité le 18 janvier 2015).
3. Association des pharmaciens des établisse-
ments de santé du Québec. Les prix d’excel-
lence et de reconnaissance 2003. [en ligne]
http://www.pharmactuel.com/sommaires
%5C200403cf.pdf (site visité le 18 janvier 2015).
4. Université de Montréal. PHA-62102. Communi-
cation scientifique en pharmacie 2. [en ligne]
https://admission.umontreal.ca/cours-et-
horaires/cours/pha-62102/ (site visité le 18 jan-
vier 2015).
Références
5. Mallet L, Méthot J. Mentorat pour la publication
durant la maîtrise en pharmacothérapie avan-
cée. Pharmactuel 2014;47:138.
6. Méthot J, Mallet L. Mentoring for publication in
a Master’s program in hospital pharmacy.
Congrès annuel AFPC/CPERC 2014, mai-juin.
Saskatoon (Saskatchewan), Canada.
7. Mallet L, Methot J. Mentoring for publication in
a Master’s degree program in hospital phar-
macy. [en ligne] http://www.ease.org.uk/node/
1012 (site visité le 18 janvier 2015).

© APES tous droits réservés Pharmactuel 2015;48(1) 7
RÉVISEURS POUR LE VOLUME 47 - ANNÉE 2014
Remerciements aux réviseurs et aux membres du comité de rédaction pour 2014
Le Pharmactuel désire souligner le travail remarquable effectué par les réviseurs et le comité de rédaction au cours de l’année
2014. En effet, tous les articles ont fait l’objet d’une révision éditoriale et linguistique. De plus, les articles de quatre chroniques
du Pharmactuel, soit Cas clinique en direct de l’unité, Évaluation critique de la documentation scientifique, Pharmacothérapie
et Recherche ont bénéficié de la révision de deux pairs. Quant aux chroniques de nature clinique (Au centre de l’information;
Gestion; Risques, qualité, sécurité; Votre expérience avec), elles ont fait l’objet de révision lorsque cela s’avérait nécessaire.
L’expertise des réviseurs et le temps consacré aux révisions ont permis d’améliorer la qualité et le contenu des articles avant
leur publication. Nous tenons également à remercier les auteurs qui ont effectué les changements demandés et ont répondu
aux commentaires, parfois nombreux, des réviseurs. Leurs efforts ont été récompensés par la publication de leur article. Merci
aux membres du comité de rédaction et du comité éditorial international qui s’investissent pour faire du Pharmactuel une
revue de qualité.
Jean-Philippe Adam
Benoit Allenet
René Blais
Maude Blanchet
Jean-Philippe Boucher
Jean-Fraçois Buissières
Jean Calop
Marie-France Drolet
Pierre Duranleau-Gagnon
Ema Ferreira
Marie-Andrée Fournier
Christine Hamel
Marie-Ève Leblanc
Vincent Leclerc
Louise Mallet
Serge Maltais
Dominic Martel
Richard Menzies
Julie Méthot
Véronique Michaud
Catherine Ouellet
Louise Papillon-Ferland
Mélissa Para
Martin Parent
Jocelyne Pépin
Marie-Claude Poulin
Roxane Pouliot
Christian Rochefort
Mounir Rhalimi
Jacynthe Roy-Petit
Nancy Sheehan
Caroline Sirois
Isabelle Taillon
Rachel Therrien
Lise Tremblay
Ursula Winterfeld
Comité de rédaction international
Benoit Allenet, Pharm.D., Ph.D.
France
Pr Yahya Bensouda
Maroc
Pr Pascal Bonnabry
Suisse
Olivier Bugnon, Pharm.D., Ph.D.
Suisse
Bruno Charpiat, D.Pharm.
France
Chantal Csajka, Ph.D.
Suisse
Bertrand Guignard, Ph.D.
Suisse
Lyne Lalonde, B.Pharm., Ph.D.
Canada
Jean Lefebvre, B.Pharm., Ph.D.
Canada
Linda Lévesque, B.Sc.Phm., M.Sc.,
Ph.D.
Canada
Felicia Loghin, Pharm.D., Ph.D.
Roumanie
Claude Mailhot, B.Pharm., DPH,
Pharm.D.
Canada
Pierre Moreau, B.Pharm., Ph.D.
Koweït
Paul Poirier, MD, Ph.D., FRCPC,
FACC, FAHA
Canada
Mounir Rhalimi. D.Pharm.
France
Pr Dolla Karam Sarkis
Liban
Anne Spinewine, M.Pharm., Ph.D.
Belgique
Pr Christian Swine
Belgique
Jacques Turgeon, B.Pharm., Ph.D.
Canada
Régis Vaillancourt, OMM, CD,
B.Pharm., Pharm.D.
Canada
Françoise Van Bambeke, Pharm.D.,
Ph.D.
Belgique

8 Pharmactuel 2015;48(1) © APES tous droits réservés
LETTRE AU RÉDACTEUR
Pour toute correspondance : Grégoire Leclair, Université de Montréal, Faculté de pharmacie, C.P. 6128, succursale Centre-ville, Montréal (Québec) H3C 3J7, CANADA;
Téléphone : 514 343-6111 (0361); Télécopieur : 514 343-2102; Courriel : gregoire.leclair@umontreal.ca
Stabilité hors emballage des comprimés de lansoprazole
orodispersibles
Alexandre Melkoumov1, B.Pharm., M.Sc., Grégoire Leclair2, B.Pharm., Ph.D.
1Candidat au Ph.D., Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
2Professeur adjoint, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada
Article reçu le 27 octobre 2014; Article accepté après révision le 11 novembre 2014
Introduction
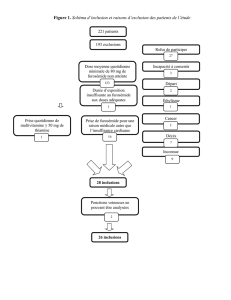
La population pédiatrique est sujette au reflux gastro-
œsophagien, aux ulcères peptiques et à d’autres
pathologies liées à l’acidité gastrique, et les cas les plus
graves nécessitent une intervention pharmacologique1,2.
Un des choix de traitement est l’administration d’un
inhibiteur de la pompe à protons (IPP). Cependant, la
majorité des IPP sont disponibles au Québec sous forme de
comprimés solides. L’administration de ces comprimés à
une population pédiatrique constitue donc un problème.
Plusieurs préparations liquides d’IPP ont été proposées,
mais aucune d’elles n’est réellement acceptable en
raison de problèmes de stabilité et d’efficacité3,4. Entre
autres, la solution de lansoprazole dans du bicarbonate
de sodium n’est pas conforme aux exigences USP pour
les formulations entériques. De plus, une formulation de
lansoprazole dans l’Orablend (Laboratoires Paddock, MN,
É.-U.) ne présente pas de stabilité à long terme acceptable4.
Conséquemment, l’hôpital pédiatrique CHU Sainte-Justine
a décidé de ne plus recommander les formulations liquides
d’IPP, mais plutôt de proposer l’utilisation de comprimés de
lansoprazole orodispersibles (PrevacidMD FasTab, Abbott
Canada, Montréal, QC, Canada). Ces comprimés sont
coupés en deux ou en quatre selon la dose désirée, puis
dissous dans de l’eau et immédiatement administrés au
patient. À défaut de connaître leur stabilité, les soignants
jettent simplement les portions inutilisées. Étant donné le
coût de ce médicament, il est intéressant de savoir si la
moitié inutilisée, sortie de son emballage, est suffisamment
stable pour être utilisée le lendemain.
Nous avons donc réalisé une étude de stabilité sur des
moitiés de comprimés de lansoprazole sortis de leur
emballage. Les comprimés de lansoprazole orodispersibles
(PrevacidMD FasTab 30 mg, Abbott Canada, lot 06038NB)
ont d’abord été coupés en deux portions égales à l’aide
d’un coupe-pilules. Nous avons évalué la variabilité entre
les demi-comprimés en mesurant le coefficient de variation
de leur masse (n = 12). Ces demi-comprimés ont ensuite
été entreposés dans un contenant ouvert et conservés à
l’abri de la lumière, à 40 °C et à 75 % d’humidité relative
pendant trois ou sept jours (n = 6 pour chaque condition
d’entreposage). Par la suite, des tests de dissolution ont
permis d’évaluer la réaction des moitiés de comprimés
soumis aux conditions de stabilité. Brièvement, les tests ont
nécessité l’utilisation d’un appareil à dissolution, tel que le
décrit la pharmacopée américaine pour les formulations
à enrobage entérique (37 °C, 75 rpm, appareil II)5. Comme
nous l’avons mentionné dans une étude antérieure4, nous
avons d’abord exposé les demi-comprimés à de l’acide
chlorhydrique (490 ml; 0,1 N; 60 min). Après le prélèvement
d’un échantillon (25 ml), du tampon phosphate (475 ml,
pH 6,8) a été ajouté au milieu de dissolution. Nous avons
prélevé des échantillons (3 ml) à des moments prédéterminés
(30, 45, 60 et 75 minutes après les 60 minutes initiales
d’exposition à l’acide chlorhydrique) avant d’ajouter, après
75 minutes, de l’hydroxyde de sodium (100 ml, 1 N) au milieu
de dissolution afin de dissoudre toute la quantité résiduelle
de lansoprazole. Enfin, un dernier échantillon a été prélevé
30 minutes plus tard. Tous les échantillons ont été analysés
selon une méthode éprouvée de chromatographie liquide à
haute performance (CLHP)4. Six moitiés de comprimés ont
été évaluées à chaque moment prédéterminé, et chaque
injection CLHP a été effectuée en triplicata.
Le coefficient de variation de la masse des demi-comprimés
était de 9,1 % (n = 12). Normalement, le coefficient de
variation de la masse des formes unitaires pharmaceutiques
devrait être inférieur à 6 % . Ce coefficient plus élevé provient
de la difficulté à couper de façon précise les comprimés
orodispersibles de lansoprazole. Toutefois, le lansoprazole
n’est pas un médicament à dose critique. Ainsi, l’imprécision
de la coupe de ces comprimés ne devrait pas être considérée
comme un frein au traitement. Les résultats que nous
avons obtenus ne montrent aucun changement de profil de
dissolution entre les comprimés qui sortent de l’emballage
et ceux vieux de trois et sept jours (figure 1). Ces résultats
témoignent de la stabilité de cette forme pharmaceutique de
lansoprazole dans les conditions évaluées.
En conclusion, il est possible de conserver les fractions
de comprimés de lansoprazole orodispersibles pendant
au moins une semaine à l’abri de la lumière et dans des
conditions n’excédant pas 40 °C et 75 % d’humidité relative.
De plus, les comprimés de lansoprazole sont difficiles à
couper de façon précise, et il faut bien veiller à obtenir des
demi-doses de masse correcte.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
1
/
57
100%