Résumé Introduction : Le complément C3 est un composant

Résumé
Introduction : Le complément C3 est un composant essentiel et le point commun de convergence des trois cascades
d'activation du complément (voies classique, alternative et des lectines) qui représente une partie importante dans le système
immunitaire.
Objectifs : Analyser la fraction Bêta-2 globuline qui correspond au composant C3 du complément des fractions des deux
systèmes d’électrophorèse : HELENA LABORATORIES et SEBIA HYDRAGEL β1-β2.
Buts : Comparaison des concentrations du C3 sérique entre patients et témoins avec ces deux différentes méthodes
d’électrophorèse (HELENA et SEBIA) suivie d’une autre comparaison entre les résultats de ces deux procédures.
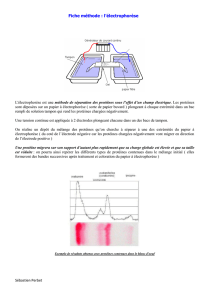
Matériels et méthodes : La fraction β2 qui correspond au composant C3 du complément d’électrophoregrammes obtenus par
deux systèmes d’électrophorèse (HELENA et SEBIA HYDRAAGEL) de 4 patients immunodéficients et 3 témoins au total a été
analysée par le logiciel imageJ.
Résultats : les résultats de notre présente étude ont apporté qu’il y’a une différence statistiquement significative entre les taux
du composant C3 du complément obtenus par électrophorèse Sebia et Helena et que les immunodifécients se caractérisent par
une modeste augmentation du C3.
Conclusion : Nos résultats préliminaires ne permettent pas de conclure qu’il y’a une différence significative entre ces deux
système d’électrophorèse et lequel entre eux est meilleur que l’autre, mais cette étude permettra d'envisager de nouvelles
perspectives de recherches.
Mots clés : Système du complément - C3 – β2 globuline – électrophorèse – Helena Laboratories – Sebia hydragel.
Abstract
Introduction: The complement C3 is an essential component and the common point of convergence of three complement
activation cascades (classical, alternative and lectin pathway) which is an important part in the immune system.
Objectives: Analyze the fraction beta-2 globulin which is the complement component C3 fractions of two electrophoresis
systems: HELENA LABORATORIES and SEBIA HYDRAGEL β1-β2.
Aim: Comparison of serum C3 concentrations between patients and controls with two different electrophoresis methods
(HELENA and SEBIA) followed by a comparison between the results of both procedures.
Materials and Methods: The β2 fraction that corresponds to the complement component C3 electrophoregrams obtained by
two electrophoresis systems (HELENA and SEBIA HYDRAGEL) of 4 immunodeficients patients and 3 control total was
analyzed by ImageJ software.
Results: The results of our present study provided that there's a significant difference between the component levels
complement C3 obtained by Sebia electrophoresis and Helena, and that immunodifécients patients are characterized by a
modest increase in C3.
Conclusion: Our preliminary results do not suggest that there's a significant difference between these two electrophoresis
systems and which of them is better than the other, but this study will consider new research perspectives.
Keywords: complement system - C3 – β2 globulin - Electrophoresis - Helena Laboratories - Sebia HydraGel
ﺧﻠﻣص:لﻣﻛﻣﻟا رﺑﺗﻌﯾC3 ﮫﻠﯾﻌﻔﺗﻟ تﺎﻘﻓدﺗ ثﻼﺛ ﺎھدﻧﻋ ﻲﻘﺗﻠﺗ ﺔﻛرﺗﺷﻣ ﺔطﻘﻧو ﺎﯾﺳﺎﺳأ ارﺻﻧﻋ)و ﺔﻠﯾدﺑﻟاو ﺔﯾﻛﯾﺳﻼﻛﻟا تارﺎﺳﻣﻟاﻼﻟانﯾﺗﻛ (ثﯾﺣﻲﻋﺎﻧﻣﻟا زﺎﮭﺟﻟا ﻲﻓ ﺎﻣﺎھ اءزﺟ لﺛﻣﯾ. فدﮭﻟا
ثﺣﺑﻟا ادھ نﻣ ءزﺟﻟا زﯾﻛرﺗ لﯾﻠﺣﺗ2ـβ نوﻛﻣﻟا لﺛﻣﯾ يذﻟا لﺻﻣﻟا ﻲﻓ نﯾﻠﯾﺑوﻠﺟC3 ﺔﯾﺋﺎﺑرﮭﻛﻟا ةرﺟﮭﻟا نﻣ نﯾﺗﻔﻠﺗﺧﻣ نﯾﺗﻘﯾرط ءازﺟأ نﻣ لﻣﻛﻣﻠﻟ:HELENA Laboratories و
SEBIA Hydragel β1-β2 . رﺻﻧﻌﻟا زﯾﻛرﺗ ﺞﺋﺎﺗﻧ نﯾﺑ ﺔﻧرﺎﻘﻣﻟا لﺟأ نﻣ كﻟد وC3ﺎﻘﺑﺎﺳ نﯾﺗروﻛذﻣﻟا نﯾﺗﻗرطﻟا نﻣ ﺎﮭﯾﻠﻋ لﺻﺣﻣﻟا دوﮭﺷﻟا و ﻰﺿرﻣﻟا نﻣ لﻛ لﺻﻣ ىدﻟ.
ﺔﯾﺣﺎﺗﻔﻣﻟا تﺎﻣﻠﻛﻟا : ـ لﻣﻛﻣﻟا مﺎظﻧC3 ـβ2 ـ ﺔﯾﺋﺎﺑرﮭﻛﻟا ةرﺟﮭﻟا ـ نﯾﻠﯾﺑوﻠﺟHelena ـSebia.


TLEMCEN
N° D’ORDRE
UNIVERSITE DE TLEMECEN – ABOU-BEKR BELKAID
FACULTE SNV/STU - DEPARTEMENT DE BIOLOGIE
Laboratoire de Biologie Moléculaire Appliquée et Immunologie
Mémoire
Présenté pour obtenir le grade
DE MASTER ll EN IMMUNOLOGIE
Par Mlle BAHBAH Ismahen
Soutenu le :
30/06/2016
Intitulé :
Analyse par ImageJ le complément C3 des fractions d’électrophorèse HELENA
Laboratories et SEBIA Hydragel β1-β2
JURY :
MrARIBI.M Professeur Président
Mme TRIQUI.Ch MAA Promoteur
Mme BRAHAMI.N MC B Examinatrice
30/06/2016
TLEMCEN
N° D’ORDRE
UNIVERSITE DE TLEMECEN – ABOU-BEKR BELKAID
FACULTE SNV/STU - DEPARTEMENT DE BIOLOGIE
Laboratoire de Biologie Moléculaire Appliquée et Immunologie
Mémoire
Présenté pour obtenir le grade
DE MASTER ll EN IMMUNOLOGIE
Par Mlle BAHBAH Ismahen
Soutenu le :
30/06/2016
Intitulé :
Analyse par ImageJ le complément C3 des fractions d’électrophorèse HELENA
Laboratories et SEBIA Hydragel β1-β2
JURY :
MrARIBI.M Professeur Président
Mme TRIQUI.Ch MAA Promoteur
Mme BRAHAMI.N MC B Examinatrice
30/06/2016
TLEMCEN
N° D’ORDRE
UNIVERSITE DE TLEMECEN – ABOU-BEKR BELKAID
FACULTE SNV/STU - DEPARTEMENT DE BIOLOGIE
Laboratoire de Biologie Moléculaire Appliquée et Immunologie
Mémoire
Présenté pour obtenir le grade
DE MASTER ll EN IMMUNOLOGIE
Par Mlle BAHBAH Ismahen
Soutenu le :
30/06/2016
Intitulé :
Analyse par ImageJ le complément C3 des fractions d’électrophorèse HELENA
Laboratories et SEBIA Hydragel β1-β2
JURY :
MrARIBI.M Professeur Président
Mme TRIQUI.Ch MAA Promoteur
Mme BRAHAMI.N MC B Examinatrice
30/06/2016

Résumé
III
Résumé
Introduction : Le complément C3 est un composant essentiel et le point commun de
convergence des trois cascades d'activation du complément (voies classique, alternative et
des lectines) qui représente une partie importante dans le système immunitaire.
Objectifs : Analyser la fraction Bêta-2 globuline qui correspond au composant C3 du
complément des fractions des deux systèmes d’électrophorèse : HELENA LABORATORIES
et SEBIA HYDRAGEL β1-β2.
Buts : Comparaison des concentrations du C3 sérique entre patients et témoins avec ces
deux différentes méthodes d’électrophorèse (HELENA et SEBIA) suivie d’une autre
comparaison entre les résultats de ces deux procédures.
Matériels et méthodes : La fraction β2 qui correspond au composant C3 du complément
d’électrophoregrammes obtenus par deux systèmes d’électrophorèse (HELENA et SEBIA
HYDRAAGEL) de 4 patients immunodéficients et 3 témoins au total a été analysée par le
logiciel imageJ.
Résultats : les résultats de notre présente étude ont apporté qu’il y’a une différence
statistiquement significative entre les taux du composant C3 du complément obtenus par
électrophorèse Sebia et Helena et que les immunodifécients se caractérisent par une
modeste augmentation du C3.
Conclusion : Nos résultats préliminaires ne permettent pas de conclure qu’il y’a une
différence significative entre ces deux système d’électrophorèse et lequel entre eux est
meilleur que l’autre, mais cette étude permettra d'envisager de nouvelles perspectives de
recherches.
Mots clés : Système du complément - C3 – β2 globuline – électrophorèse – Helena
Laboratories – Sebia hydragel.

Abstract
IV
Abstract
Introduction: The complement C3 is an essential component and the common point of
convergence of three complement activation cascades (classical, alternative and lectin
pathway) which is an important part in the immune system.
Objectives: Analyze the fraction beta-2 globulin which is the complement component C3
fractions of two electrophoresis systems: HELENA LABORATORIES and SEBIA
HYDRAGEL β1-β2.
Aim: Comparison of serum C3 concentrations between patients and controls with two
different electrophoresis methods (HELENA and SEBIA) followed by a comparison between
the results of both procedures.
Materials and Methods: The β2 fraction that corresponds to the complement component C3
electrophoregrams obtained by two electrophoresis systems (HELENA and SEBIA
HYDRAGEL) of 4 immunodeficients patients and 3 control total was analyzed by ImageJ
software.
Results: The results of our present study provided that there's a significant difference
between the component levels complement C3 obtained by Sebia electrophoresis and
Helena, and that immunodifécients patients are characterized by a modest increase in C3.
Conclusion: Our preliminary results do not suggest that there's a significant difference
between these two electrophoresis systems and which of them is better than the other, but
this study will consider new research perspectives.
Keywords: complement system - C3 – β2 globulin - Electrophoresis - Helena Laboratories -
Sebia HydraGel
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
1
/
30
100%