oxydo réduction

Page 1 sur 4
But des manipulations :
- Être capable de réaliser et d’interpréter une réaction d’oxydo-réduction
.
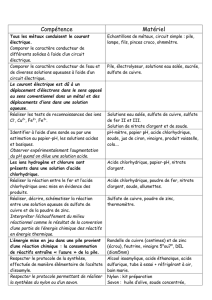
Compétences mise en oeuvre :
- Identifier des ions en solution
Matériel par poste :
- 8 tubes à essai
- 3 béchers dont un étiqueté « récupération des produits usagers »
- Porte-tube
- Laine de fer
- Lame de cuivre
Produits par poste :
- Sulfate de cuivre
- Sulfate de fer
- Soude
- Chlorure de baryum
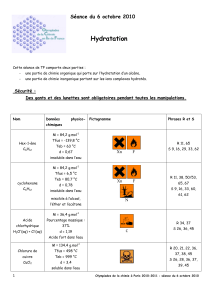
Remarque :
Ce TP d’introduction au cours sur l’oxydo-réduction est de niveau CAP coiffure. Il permet de
réinvestir ce qui a été vu sur l’identification des ions en solution.
TP : OXYDO - REDUCTION
Fiche descriptive à l’attention du professeur

Page 2 sur 4
appeler le professeur pour vérifier les observations
TP : OXYDO - REDUCTION
But des manipulations :
On va étudier la réaction entre un métal et un ion métallique.
I. Action du fer sur une solution de sulfate de cuivre :
1. Manipulations :
• Placer le fer dans le bécher et le recouvrir de sulfate de cuivre.
On va maintenant identifier les ions présents initialement dans la solution.
• Verser 1 cm3 de sulfate de cuivre dans deux tubes à essai n°1 et n°2.
• Verser quelques gouttes de soude dans le tube n°1 et quelques gouttes de chlorure de
baryum dans le tube n °2.
L’expérience suivante va nous permettre d’identifier les ions présents dans la solution à la fin
de l’expérience.
• Retirer le fer du bécher et répartir la solution dans les deux tubes à essai n°3 et n°4.
• Verser quelques gouttes de soude dans le tube n°3 et quelques gouttes de chlorure de
baryum dans le tube n °4
2. Observations :
• Quelle est la couleur initiale du fer ?
• Quelle est la couleur initiale du sulfate de cuivre ?
• Qu’apparaît-il sur la laine de fer ?
• Quelle est la couleur de la solution contenue dans le bécher à la fin de la réaction ?
• Compléter le tableau suivant à l’aide de l’annexe :
Tubes Couleur du précipité Ion présent
N°1
Solution initiale N°2
N°3
Solution finale N°4

Page 3 sur 4
3. Interprétation :
• Les ions cuivre sont devenus du cuivre métal qui s’est déposé sur le fer.
Compléter l’équation suivante pour qu’elle soit électriquement neutre :
Cu
2+ + Cu
• Le fer métal a donné des ions fer Fe2+ qui ont coloré la solution.
Compléter l’équation suivante pour qu’elle soit électriquement neutre :
Fe Fe
2+ +
• La réaction étudiée correspond donc à un transfert d’électrons du fer métal vers les ions
cuivre. On l’appelle une réaction d’oxydo-réduction.
II. Action du cuivre sur une solution de sulfate de fer :
1. Manipulations :
• Placer la lame de cuivre dans le bécher et verser dessus du sulfate de fer.
• Verser 1 cm3 de sulfate de fer dans deux tubes à essai n°5 et n°6.
• Verser quelques gouttes de soude dans le tube n°5 et quelques gouttes de chlorure de
baryum dans le tube n °6.
• Retirer le cuivre du bécher et répartir la solution dans les deux tubes à essai n°7 et n°8.
• Verser quelques gouttes de soude dans le tube n°7 et quelques gouttes de chlorure de
baryum dans le tube n °8
2. Observations :
• Compléter le tableau suivant à l’aide de l’annexe :
Tubes Couleur du précipité Ion présent
N°5
Solution initiale N°6
N°7
Solution finale N°8
3. Interprétation :
La réaction spontanée entre un ion métallique et un métal n’est possible que dans un sens.

Page 4 sur 4
III. Remise en état du poste :
• Vider le contenu des tubes à essais et des béchers dans le bécher étiqueté
« récupération des produits usagés ».
• Les rincer à l'eau du robinet .
• Nettoyer le plan de travail.
Annexe
Ion Réactif Couleur du précipité
Cl- AgNO3 ( nitrate
d’argent ) blanc ( AgCl )
Cu2+ NaOH (soude) bleu Cu(OH)2
Mg2+ jaune thiazole +
NaOH ( qq gouttes ) rouge groseille
Pb2+ KI jaunâtre ( PbI2 )
Zn2+ NaOH (soude) blanc Zn (OH)2
−2
4
SO BaCl2 (chlorure de
baryum ) blanc BaSO4
Fe2+ NaOH (soude) vert Fe(OH)2
appeler le professeur pour vérifier la remise en état du poste de travail
1
/
4
100%