Cours 4 Cinétique et catalyse

Cours 4 Cinétique et catalyse
Manuel / chapitre 13 p259
Exercices recommandés : 2,3, 7, 15, 23,29
A - Intro, rappels, définitions
Cinétique : partie de la chimie qui s’intéresse aux vitesses des réactions chimiques.
Ceci a toute son importance dans les process industriels, ou l’on souhaite que la réaction se fasse le plus vite possible.
Par ailleurs, il faut réaliser que lorsque l’on met en présence des réactifs, plusieurs réactions sont souvent possibles, dont la
vitesse dépend des conditions expérimentales. Une bonne connaissance de la cinétique de ces réactions permet donc dans
certains cas d’obtenir à partir des mêmes réactifs, des produits différents .
Facteur cinétique : paramètre contrôlable capable de modifier la durée d’une réaction. Les principaux facteurs cinétiques
sont la température et la concentration (influence sur la fréquence des collisions entre entités) mais aussi (en phase liquide)
les propriétés physico-chimiques du solvant utilisé.
Système chimique : ensemble des espèces chimiques en présence
Réaction chimique : représentation simplifiée d’une transformation chimique (processus souvent très complexe) ,
représentée par une équation-bilan . Ex : H30+ + HO- 2 H20
Phase : portion de matière homogène solide, liquide ou gazeuse (rem : tous les gaz sont homogènes car miscibles)
Avancement d’une réaction noté x, parfois : nombre de réactions qui se sont produites suivant l’équation bilan (en mol)
Avancement final : valeur de x pour laquelle le système chimique n’évolue plus.
Avancement maximal xmax : valeur maximale de l’avancement dans l’hypothèse où la réaction est totale.
xmax est atteint lorsqu’un réactif vient à manquer (réactif limitant).
Ex :
: Nous verrons (chapitre acide-base) qu’il existe des cas ou xfinal < xmax car certaines réactions peuvent se produire dans les
deux sens (par ex : CH3COOH + H20 CH3COO- + H30+ ) . Dans ce cas pour déterminer xf on a besoin d’autres informations.
Durée de réaction :
durée au bout de laquelle le système n’évolue plus (x = xf)
ou éventuellement durée pour laquelle x atteint une valeur précise , décidée par l’opérateur.
Temps de demi-réaction t1/2 : durée telle que x = xmax /2
C’est donc la durée pour laquelle n ou C d’un réactif limitant voit sa valeur initiale divisée par 2 . (voir ex ci après)
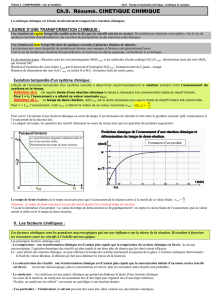
B - Evolution dans le temps d’un système chimique
Si la transformation est lente, elle peut être suivie en laboratoire par différentes méthodes suivant la réaction en jeu .
Ex : Soit la réaction totale 2 Ag+ + Fe 2 Ag + Fe2+
a) complétez le tableau d’avancement
b) déterminez la durée de la réaction
c) déterminez le temps de demi-réaction t1/2
d) t1/2 est-il la moitié de la durée de réaction ?
-
Rem : comme la quantité de matière initiale des produits est nulle, on peut également déterminer t1/2 à partir de l’évolution
de la concentration [Fe2+]
avancement
Fe + S Fe
n (mol) n(mol) n(mol)
Etat initial
x=0
0,40
0,02
0
Après x
réactions
x
0,40 -x
0.02-x
x
Etat final
xfinal = xmax =0,02
0.38
0
0.02
Réaction
2 Ag+ + Fe 2 Ag + Fe2+
Quantités de matière
Etat initial
x =
0.08
3
0
0
En cours
x
Etat final
xf =

C - Catalyse
Un catalyseur est une espèce chimique qui diminue notablement la durée d’une transformation .
Dans tous les cas, un catalyseur a pour particularité d’être intact en fin de réaction, de sorte qu’il n’apparaît pas dans le bilan.
(certains catalyseurs –par ex les ions H30+ dans une estérification) prennent activement part à la réaction , en venant former des
liaisons avec les molécules en présence ; mais contrairement aux « réactifs » même s’ils ont momentanément été modifiés ils
sont toujours « régénérés » à la fin. ) . On distingue :
Définition
Exemple
avantages
inconvénients
Catalyse
homogène
Réactifs et
catalyseur se
trouvent dans la
même phase
Doc1
Excellent contact entre entités
(car distinctes)
Toutes les molécules de
catalyseur sont disponibles
bons rendements
Difficulté à séparer le catalyseur
du milieu réactionnel en fin de
réaction
Catalyse
hétérogène
Le catalyseur n’est
pas dans la même
phase que les
réactifs
TP : dismutation de H2O2(aq) par
MnO2 (s)
(doc2) pot catalytique
Industrie alimentaire :
hydrogénation d’huile(l)
catalysée par le Nickel (solide)
margarines
Contact moins optimal qu’en
catalyse homogène entre les
réactifs et le catalyseur
Catalyseur aisément séparable
du milieu réactionnel et
réutilisable
Catalyse
enzymatique
Le catalyseur est
une proteïne
TP (foie ou radis)
Evite de recourir à un facteur
cinétique (et donc économie
d’énergie et/ou de réactifs)
Méthode plus respectueuse de
l’environnement
L’efficacité du catalyseur
dépend de conditions
expérimentales précises et
souvent contraignantes (PH,
température, solvant…)
Doc 1 Réaction ions tartrate + eau oxygénée
Equation bilan 5 H2O2(aq) + 2 H3O+(aq) + C4H4O62–(aq) 10 H2O( l ) + 4 CO2 (g)
Catalyseur de la réaction : ions Cobalt (roses sous la forme Co2+, verts sous la
forme Co3+ en solution aqueuse)
a) A quoi est due la mousse ?
b) Que montrent les différents changements de couleur ?
c) Cette catalyse est-elle homogène ou hétérogène et pourquoi ?
……………………………………………………………………………………………………………………………………………………………………………………
Temps de demi-réaction / Exercice complémentaire
On étudie la cinétique de la transformation lente et totale de
décomposition de l’eau oxygénée par les ions iodure en présence d’acide
sulfurique. Initialement, on introduit 3,2 mol d’eau oxygénée, 2,8 mol
d’iodure de potassium et 3 mol d’ions oxonium.
a) Que signifie « transformation totale » ?
b) Compléter le tableau d’avancement
c) Déterminer l’avancement maximal et le réactif limitant .
d) Comment pourrait-on suivre l’évolution de x en fonction du temps t ?
( I2 en solution donne une coloration brune à l’eau)
e) Quelle est la durée de la réaction ?
f) Quel est le temps de demi-réaction ?
Réaction
H2O2(aq) + 2 I–
(aq) + 2 H3O+
(aq) -> I2(aq) + 4 H2O(l)
Quantités de matière
E.I.
x = 0
Après x
réactions
x
E.F.
xmax =
1
/
2
100%