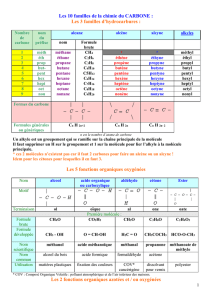
Chimie Organique : Introduction pour Lycée (1S)

Chimie II : 1S La chimie créatrice
Chapitre 7 : Introduction à la chimie organique
I. La chimie organique.
1. Molécules organiques :
Une molécule organique est une molécule comportant, en général, du carbone C et de l’hydrogène H.
Une molécule organique peut comporter d’autres éléments que le carbone et l’hydrogène, comme de l’oxygène O, de
l’azote N, du phosphore P, etc.
Exemples de molécules organiques :
Le méthane : CH
4
L’éthanol : C
2
H
6
O Le paracétamol : C
8
H
10
O
2
N
La chimie des molécules organiques s’appelle la chimie organique.
Dans les molécules organiques, l’élément le plus important est le carbone car c’est lui qui est responsable de
l’architecture des molécules, on appelle parfois la chimie organique << chimie du carbone>>.
Il existe plusieurs millions de molécules organiques : on rencontre molécules très simples ne comportant que quelques
atomes (CH
4
, C
2
H
6
, C
2
H
6
O, etc) et des molécules plus complexes comportant plusieurs millions d’atomes (ADN).
Remarque :
On oppose la chimie organique et la chimie minérale qui est l’étude des molécules qui ne répondent pas à la définition
précédente, comme le dioxyde de carbone de formule CO
2
ou le permanganate de potassium de formule KMnO
4
.
2. Origine des molécules organiques :
Deux origines possibles :
II. Les liaisons autour de l’atome de carbone.
Les liaisons entre les différents atomes dans molécule organique sont des liaisons covalentes.
1. Covalence (nombre de liaisons) du carbone :
L’atome de carbone C a pour numéro atomique Z = 6.
Sa structure électronique est : (K)
2
(L)
4
, il possède donc 2 électrons sur la première couche électronique K et
4 électrons sur la deuxième couche L.
Il manque donc 4 électrons au carbone pour saturer sa dernière couche électronique à 8 électrons (Règle de l’octet).
Le carbone formera donc 4 liaisons covalentes autour de lui : on dit qu’il est tétravalent.
2. Liaisons carbone-carbone :
Liaison simple : Liaison double : Liaison triple :
3. Liaisons carbone-hydrogène :
L’atome d’hydrogène H a pour numéro atomique Z = 1
Sa structure électronique est : (K)
1
, il possède 1 électron sur sa première couche K.
Il lui manque 1 électron pour saturer sa couche à 2 électrons (Règle du duet).
L’hydrogène formera donc une seule liaison covalente autour de lui : il est monovalent.
Chimie II : 1S 1/4
Molécules d’origine naturelle Molécules d’origine synthétiques (fabriquées par l’Homme)
Extraites des végétaux et des animaux
:
• Les colorants
• Les parfums
• Les sucres, etc.
Molécules identiques aux espèces naturelles car la synthèse
est moins chère que l’extraction :
• Les colorants
• Les arômes, etc
Extraites des sous
-
sols (les hydrocarbures)
:
• Le gaz de ville (Méthane)
• Le pétrole
Molécule n’existant pas dans la nature, appelées molécules
artificielles :
• Le nylon
• Les matières plastiques, etc.
C C
C C
C
H
C C

4
.
Liaisons carbone-oxygène :
L’atome d’oxygène O a pour numéro atomique Z = 8.
Sa structure électronique est : (K)
2
(L)
6
, il possède 6 électrons sur sa dernière couche L.
Il lui manque deux électrons pour saturer sa couche à 8 électrons (Règle de l’octet).
L’oxygène formera donc 2 liaisons covalentes autour de lui : il est divalent.
Liaison simple : Liaison double :
5. Liaisons carbone-azote :
L’atome d’azote N a pour numéro atomique Z = 7.
Sa structure électronique est : (K)
2
(L)
5
, il possède 5 électrons sur sa dernière couche L.
Il lui manque trois électrons pour saturer sa couche à 8 électrons.
L’azote formera donc trois liaisons covalentes autour de lui : il est trivalent.
Liaison simple : Liaison double :
Liaison triple :
III. Les différentes représentations des molécules.
1. Formule brute :
La formule brute d’une molécule est du type C
x
H
y
O
z
(il peut y avoir d’autres éléments)
On écrit côte à côte les symboles des atomes présents dans la molécule, et si un même atome est présent plusieurs
fois, on le précise en indice en bas à droite du symbole correspondant.
Exemple :
C
2
H
6
O contient 2 atomes de carbone, 6 atomes d’hydrogène et un atome d’oxygène.
2. Formule développée :
C’est l’écriture de la molécule dans laquelle sont représentées toutes les liaisons covalentes entre tous les atomes.
Exemple de la molécule ci-dessus :
3. Formule semi-développée :
C’est l’écriture de la molécule dans laquelle toutes les liaisons covalentes sont représentées, sauf celles avec l’atome
d’hydrogène.
Exemple de la molécule ci-dessus :
Les liaisons représentées sont des liaisons entre les atomes de carbone, et non pas entre un carbone et un hydrogène.
4. Représentation de Lewis :
C’est l’écriture de la molécule dans laquelle tous les doublets liants (liaisons covalentes) et non liants sont représentés.
Exemple ci-dessus :
Chimie II : 1S 2/4
C O C O
C N
C
N
N
C
H
H
H
H
O
H
H
C C
CH
3
CH
2
OH
H
H
H
H
O
H
H
C
C
Doublet non
liant

Règles pour attribuer les doublets non liants :
• Tous les éléments veulent s’entourer de 8 électrons (Règle de l’octet), sauf l’hydrogène qui n’en a besoin que deux
autour de lui (Règle du duet)
• Chaque liaison covalente et doublet non liant compte 2 électrons.
Décompte du nombre d’électrons autour de l’atome d’oxygène :
• 4 provenant des 2 liaisons covalentes (2 x 2)
• 4 provenant des 2 doublets non liants (2 x 2)
Afin de trouver les représentations de Lewis à partir de la formule brute, on utilise le tableau suivant :
Exemple de la molécule de fluorométhane de formule brute CH
3
F.
C : Z = 6 H : Z = 1 F : Z = 9
Formule brute CH
3
F
1. Ecrire la structure électronique de chaque
atome de la molécule
C
: (K)
2
(L)
4
H
: (K)
1
F
: (K)
2
(L)
7
2. En déduire le nombre n
e
d’électrons libres
(externes) de chaque atome.
C
: n
e
= 4 H
: n
e
= 1 F
: n
e
= 7
3. En déduire le nombre de liaisons formées par
chaque atome (la covalence), en appliquant
les règles de l’octet et du duet.
C
: 4 liaisons H
: 1 liaison F
: 1 liaison
4. Calculer le nombre total n
t
d’électrons
périphériques de la molécule puis le nombre n
d
de doublets liants et non liants
n
t
= 4
+ 3 x 1 + 7 = 14
n
d
= n
t
2 = 14
2 = 7
5. Placer les doublets liants entre les atomes en
respectant la covalence de chaque atome.
6. Affecter les doublets restants en doublets non
liants pour respecter :
• La règle du duet pour l’hydrogène
• La règle de l’octet pour les autres atomes
Exercices d’application n°1/2/3
5. Ecriture topologique :
Quelques règles sont à respecter afin de donner l’écriture topologique d’une molécule.
• Les liaisons carbone-carbone sont représentées par des segments de droites, disposés en zigzag.
• Par convention, les extrémités de chaque segment représentent un atome de carbone.
• On ne représente pas les atomes d’hydrogène nécessaires aux atomes de carbone pour satisfaire à la règle de
l’octet.
• Les atomes, autres que le carbone et l’hydrogène, sont représentés par leur symbole, ainsi que les atomes
d’hydrogène qu’ils portent.
Exemple de la molécule d’éthanol : C
2
H
6
O
Formule semi-développée : Ecriture topologique :
Exercices d’application n°4/5
Chimie II : 1S 3/4
8 électrons
H
H
F
C
H
H
H
F
C
H
CH
3
CH
2
OH
OH

IV. Isomérie.
Deux molécules ayant une même formule brute mais des formules développées, semi-développées et topologiques
différentes sont appelées isomères.
Exemple de la molécule d’éthanol C
2
H
6
O :
On dit que ces 2 molécules sont des isomères ou que la relation entre ces 2 molécules est une relation d’isomérie.
Exercice d’application n°6.
V. Géométrie des molécules.
Pour rendre compte de la géométrie spatiale des molécules, on utilisera la représentation de Cram.
1. Carbone possédant 4 liaisons simples :
La géométrie autour du carbone est tétraédrique : l’angle entre chacune des 4 liaisons est de 109°.
2. Carbone possédant 2 liaisons simples et une liaison double :
Les 4 liaisons sont dans le même plan : l’angle entre chacune des 3 liaisons est de 120°.
3. Carbone possédant une liaison simple et une liaison triple :
La géométrie de la molécule est linéaire autour du carbone : l’angle entre chacune des deux liaisons est de 180°.
4. Le squelette carboné :
La forme des molécules organiques est donnée par l’enchaînement des atomes de carbone appelée
squelette carbonée ou chaîne carbonée.
Exemple de la molécule de propane de formule brute C
4
H
10
: voir vidéoprojection
La forme de la molécule est donnée par l’enchaînement des 4 atomes de carbone.
Exercice d’application n°7
Chimie II : 1S 4/4
H
H
H
H
O
H
H C C
C
H H
H
H
O
H
H
C
H
C
H
H
H
H
H
HH
:
Liaison à l’arrière du plan de la feuille
:
Liaison en avant du plan de la feuille
:
Liaison dans le plan de la feuille
C
N
C
1
/
4
100%