Réponses à vos questions sur MULTAQMC

Réponses à vos questions sur MULTAQMC
Qu’est-ce que MULTAQMC et quelle est
son indication?
MULTAQMC (chlorhydrate de dronédarone) est
un agent antiarythmique indiqué pour le traite-
ment des patients qui présentent ou qui ont déjà
présenté une fibrillation auriculaire (FA), afin
de réduire le risque d’hospitalisation pour cause
d’affection cardiovasculaire attribuable à la fibril-
lation auriculaire1.
Quelles sont les contre-indications
de MULTAQMC?
MULTAQMC est contre-indiqué :
• chez les patients qui souffrent d’insuffisance
cardiaque congestive grave (de stade IV selon la
NYHA) ou d’une autre affection entraînant un
état hémodynamique instable;
• chezles patients qui présententun bloc auriculo-
ventriculaire du deuxième ou du troisième
degré ou une maladie du nœud sinusal (sauf s’il
est utilisé conjointement avec un stimulateur
cardiaque qui fonctionne);
• chez les patients qui souffrent de bradycardie
(< 50 bpm);
• chezlespatientsquiprennentenconcomitance
de puissants inhibiteurs de la CYP 3A4, tels que
lekétoconazole,l’itraconazole,levoriconazole,
la cyclosporine, la télithromycine, la clarithro-
mycine,lanéfazodoneetleritonavir;
• chez les patients qui prennent en concomi-
tance des médicaments pouvant provoquer
des torsades de pointes, tels que les phénothia-
zines,lesantidépresseurstricycliquesetcertains
macrolides administrés par voie orale, les anti-
arythmiques de classes I et III;
• chez les patients qui présentent un intervalle
QT ≥ 500 ms calculé selon la formule de
Bazett;
• enprésenced’uneinsuffisancehépatiquegrave;
• durantlagrossesseetl’allaitement;et
• chez les patients qui ont déjà présenté des réac-
tions d’hypersensibilité à la dronédarone ou à l’un
des composants du produit ou du contenant1.
MULTAQMC peut-il être utilisé chez les
enfants?
L’innocuité et l’efficacité du médicament n’ont
pasétéétablieschezlesenfantsâgésdemoinsde
18 ans et l’utilisation de MULTAQMC n’est donc
pas recommandée dans leur cas.1
MULTAQMC peut-il être utilisé durant
la grossesse?
L’emploi de MULTAQMCestcontre-indiquéchez
les femmes enceintes ou qui pourraient le devenir.
Les femmes capables d’avoir des enfants doivent
utiliser des moyens contraceptifs efficaces durant
le traitement par MULTAQMC 1.
MULTAQMC peut-il être utilisé durant
l’allaitement?
On ne sait pas si MULTAQMC est excrété dans le
lait maternel. Par conséquent, on doit conseiller
aux mères à qui l’on prescrit un traitement par
MULTAQMC de mettre fin à l’allaitement1.
MULTAQMC peut-il être utilisé chez les
personnes âgées?
MULTAQMC a été étudié sur plus de 4 500
patients âgés de 65 ans ou plus présentant une
fibrillation auriculaire ou un flutter auriculaire
(dont plus de 2000 patients âgés de 75 ans ou
plus). MULTAQMC s’est révélé d’une efficacité et
d’une innocuité comparables chez les personnes
âgéesetlespatientsplusjeunes1.
Sous quelle forme et à quelle puissance est
présenté MULTAQMC?
MULTAQMC se présente en comprimés desti-
nés à l’administration par voie orale. Chaque
comprimé de MULTAQMC renferme du chlo-
rhydrate de dronédarone équivalant à 400 mg
de dronédarone1.
Quelle est la dose recommandée
de MULTAQMC?
Les patients doivent prendre une dose fixe de
MULTAQMC.Ladoserecommandéechezl’adulte
est d’un comprimé de 400 mg deux fois par jour,
au petit-déjeuner et au souper. Aucune dose de
charge ni titration n’est nécessaire et les patients
commencent le traitement à raison de 400 mg
deux fois par jour dès le premier jour1.
Faut-il ajuster la dose de MULTAQMC chez les
personnes atteintes d’insuffisance rénale ou
hépatique?
Aucun ajustement de dose n’est nécessaire chez
les personnes atteintes d’insuffisance rénale.
MULTAQMC est minimalement excrété par les
reins. MULTAQMC est contre-indiqué chez les
patients présentant une insuffisance hépatique
grave1.
Peut-on réduire en poudre les comprimés
de MULTAQMC?
On ne dispose pas de données relatives à l’efficacité
des comprimés réduits en poudre. Par conséquent,
il n’est pas recommandé de le faire1.
Peut-on couper les comprimés de
MULTAQMC?
La dose recommandée de MULTAQMC est de
400 mg deux fois par jour. Le fait de couper les
comprimés modifie la dose recommandée. On ne
dispose pas de données relatives à l’innocuité ou
à l’efficacité d’autres doses que 400 mg deux fois
par jour. Par conséquent, il n’est pas recommandé
de couper les comprimés1.
Que doit faire le patient en cas d’oubli
d’une dose?
Une dose oubliée doit être sautée et le patient
doit attendre l’heure prévue de la prochaine dose
et continuer de prendre le médicament selon
l’horaire habituel. Il ne faut pas prendre deux
doses à la fois1.
Comment MULTAQMC doit-il être conservé?
Il faut conserver MULTAQMC à 25 °C, en
limitant les écarts de température entre 15 et
30 °C, et garder le produit dans son emballage
d’origine1.
Quel est le mode d’action de MULTAQMC?
MULTAQMC est un bloqueur de multiples
canaux qui inhibe les courants potassiques, ce
qui a pour effet d’accroître la durée du potentiel
d’action cardiaque et de prolonger les périodes
réfractaires (classe III). Il inhibe aussi les cou-
rants sodiques (classe Ib) et calciques (classe IV).
Enfin, il exerce un effet anti-adrénergique non
compétitif (classe II)1.
Comment MULTAQMC est-il absorbé?
MULTAQMC doit être pris avec des aliments.
Après son administration par voie orale à la suite
d’un repas, il est bien absorbé (dans une propor-
tiond’aumoins70%)danslesintestins,d’oùil
accède à la circulation générale. Toutefois, en rai-
son de la biotransformation présystémique (effet
de premier passage), la biodisponibilité absolue
de la dronédarone (administrée avec des aliments)
s’établità15%1.

Comment MULTAQMC est-il métabolisé?
La dronédarone subit une biotransformation
importante, laquelle dépend surtout de la
CYP 3A41.
Comment MULTAQMC est-il excrété?
Aprèsl’administrationparvoieorale,environ6%de
la dose radiomarquée est excrétée dans l’urine, prin-
cipalement sous forme de métabolites (absence de
substanceinchangéeexcrétéedansl’urine),et84%
est excrétée dans les fèces, principalement sous forme
de métabolites. La demi-vie d’élimination terminale
de la dronédarone est d’environ 25 à 30 heures, et
celle de son métabolite (N-débutyle), d’environ 20 à
25heures.Chezlespatients,ladronédaroneetson
métabolite sont complètement éliminés du plasma
dans les deux semaines qui suivent la fin d’un traite-
ment à la dose de 400 mg, deux fois par jour1.
Quelle est l’efficacité de MULTAQMC?
Dans l’étude ATHENA, la plus vaste étude jamais
publiée sur la fibrillation auriculaire, MULTAQMC a
permis de réduire significativement le risque de pre-
mière hospitalisation pour cause d’affection cardio-
vasculaire ou de mortalité toutes causes confondues
(critère d’évaluation composé principal). En ce qui
concerne le deuxième critère d’évaluation – la mor-
talité toutes causes confondues –, la différence entre
le nombre de décès dans les deux groupes de traite-
ment n’a pas atteint la signification statistique1,2*.
RRR24,2%
NNT=13
NNT=nombre de sujets qu’il est nécessaire de traiter. Adapté
de la monographie de produit de MULTAQMC et de Hohnloser SH
.
MULTAQMC a permis de réduire significa-
tivement le risque de première hospitalisation
pour cause d’affection cardiovasculaire (critère
d’évaluation secondaire)1,2*.
RRR26%
NNT=13
Adapté de la monographie de produit de MULTAQMC et de
Quel a été l’effet de MULTAQMC sur la FA et en
quoi cela a-t-il été lié aux hospitalisations
pour cause d’affection cardiovasculaire?
La réduction des hospitalisations pour cause
d’affection cardiovasculaire a été le résultat de la
réduction des récurrences de FA et d’autres aryth-
mies supraventriculaires1†.
NNT=13
Adapté de la monographie de produit de MULTAQMC .
Quelle a été l’efficacité de MULTAQMC dans
la réduction des hospitalisations pour cause
d’affection cardiovasculaire dans différents
sous-groupes de patients qui recevaient un
traitement en concomitance?
La diminution des hospitalisations pour cause
d’affection cardiovasculaire ou des décès toutes
causes confondues a été constante dans l’ensemble
des sous-groupes, quels que soient les caracté-
ristiques initiales des sujets et les médicaments
qu’ils prenaient en concomitance. La réduction
du critère d’évaluation principal a été constante
dans tous les sous-groupes de patients étudiés qui
recevaient également un traitement habituel1,2*.
-
atteints de FA ou de flutter auriculaire (FLA) paroxystique ou
traitements courants comprenaient notamment les médi-
caments utilisés pour régulariser la fréquence cardiaque
(p. ex., les bêtabloquants, les antagonistes du calcium et la
digoxine), les antithrombotiques (p. ex., les antagonistes de
-
confondues », la différence entre le nombre de décès
† MULTAQMC n’est pas indiqué pour le traitement des arythmies
Adapté de la monographie de produit de MULTAQMC et de
(a) Déterminé d’après le modèle de régression
de Cox.
(b) Valeur de p de l’interaction entre les carac-
téristiques initiales et le traitement, selon le
modèle de régression de Cox.
(c) Les antagonistes du calcium ayant pour effet
de diminuer la fréquence cardiaque se sont
limités au diltiazem, au vérapamil et au
bépridil.1
Fréquence de première hospitalisation pour
cause d’affection cardiovasculaire ou de mortalité
toutes causes confondues
Fréquence de première hospitalisation pour cause
d’affection cardiovasculaire
Fréquence des hospitalisations pour cause d’affection
cardiovasculaire dues à la FA ou à d’autres arythmies
supraventriculaires durant la période de l’étude
Analyses de sous-groupes sélectionnés –
Critère d’évaluation principal

L’efficacité de MULTAQMC a-t-elle été
démontrée dans d’autres études que l’étude
ATHENA?
Dans l’analyse des études EURIDIS et ADONIS
regroupées réalisée par la suite, MULTAQMC
a permis de réduire significativement le risque
d’hospitalisation pour cause d’affection cardiovas-
culaire ou de mortalité toutes causes confondues3‡.
RRR27%
.
ayant déjà présenté une FA ou un FLA ont été randomisés
-
les antagonistes du calcium (pour diminuer la fréquence
cardiaque), les bêtabloquants (à l’exception du sotalol), les
anticoagulants oraux, les traitements antiplaquettaires au
long cours, les statines et les inhibiteurs de l’enzyme de
Qu’a démontré le profil d’innocuité
de MULTAQMC?
Le profil d’innocuité de la dronédarone admi-
nistrée à raison de 400 mg deux fois par jour re-
pose sur cinq études comparatives avec placebo
portantsur6285sujets(dont3282ontététrai-
tés par MULTAQMC), soit les études ATHENA,
EURIDIS, ADONIS, ERATO et DAFNE.
D’après l’expérience clinique, la dronédarone
exerce un faible effet proarythmique. Cependant,
des effets proarythmiques peuvent se manifester
dans des situations particulières, telles que la
prise concomitante de médicaments favorisant
l’arythmie et/ou les troubles électrolytiques1.
Au cours des essais cliniques, l’administration
concomitante de MULTAQMC et d’anticoagulants
oraux n’a pas soulevé de préoccupation liée à
l’innocuité. Dans un essai clinique, MULTAQMC
(600 mg, deux fois par jour) a eu pour effet
d’augmenter de 1,2 fois l’exposition à la S-warfarine,
sans toutefois modifier l’exposition à la R-warfa-
rine,etn’aaugmentéleRNIquede1,07fois1.
Quel est le profil de tolérabilité de MULTAQMC?
MULTAQMC a été généralement bien toléré. Les
raisons d’abandon du traitement par MULTAQMC
les plus fréquemment invoquées ont été les trou-
blesintestinaux(3,2%vs1,8%avecleplacebo).
Dans les cinq études, un abandon prématuré du
faitd’effetsindésirabless’estproduitchez11,8%
des sujets traités par MULTAQMCetchez7,7%
des sujets du groupe placebo1.
Quelles sont les réactions indésirables
les plus fréquemment rencontrées avec
MULTAQMC?
Les effets indésirables survenus à une fréquence
≥1%chezlessujetsdesgroupesdronédaronedes
essais cliniques contrôlés par placebo ont été1 :
Des effets indésirables moins courants observés
au cours des essais cliniques (< 1 %) ont été des
troubles du système nerveux (agueusie et dysgueu-
sie), des problèmes de peau et de tissus sous-cutanés
(dermatite,dermatiteallergique,eczéma,érythèmes
[incluant l’érythème et l’éruption cutanée érythé-
mateuse] et réaction de photosensibilité)1.
Quel est l’effet de MULTAQMC sur la
créatinine plasmatique?
MULTAQMC a souvent provoqué une élévation
de la créatine plasmatique (élévation moyenne
d’environ 10 µmol/L) peu de temps après le début
du traitement, mais qui a atteint un plateau au
bout de sept jours. Les valeurs sont revenues telles
qu’elles se présentaient au départ au cours de la
semaine ayant suivi l’arrêt du traitement1.
Des études portant sur des sujets en bonne
santé ont montré que cette élévation était liée à
l’inhibition de la sécrétion de créatinine au niveau
tubulaire sans que cela ait d’effet sur la filtration
glomérulaire ou sur le débit sanguin rénal1,4§.
§ Dans une étude croisée randomisée, contrôlée par placebo et
ou un placebo, pendant sept jours. Les mesures de base et en
cours de traitement de la fonction rénale ont été effectuées
l’excrétion électrolytique de la créatinine, de la sinistrine, du
para-amino-hippurate et du N-méthylnicotinamide.
À quelle fréquence faut-il mesurer la
créatinine plasmatique au cours d’un
traitement par MULTAQMC?
Il est recommandé de mesurer le taux de créati-
nine plasmatique sept jours après la mise en route
du traitement. Si les résultats obtenus se situent
au-dessus de la limite supérieure de la normale, il
faut utiliser cette nouvelle mesure comme valeur
de référence1.
Devrait-on abandonner un traitement par
MULTAQMC en cas d’élévation de la
créatininémie?
Une élévation de la créatininémie ne commande
pas nécessairement l’interruption du traitement
par MULTAQMCniparlesinhibiteursdel’enzyme
de conversion de l’angiotensine (IECA) ou les
antagonistes des récepteurs de l’angiotensine II
(ARA)1.
Devrait-on abandonner un traitement par
MULTAQMC chez un patient qui expérimente
des effets secondaires?
Tout patient peut expérimenter des effets
secondaires. Le traitement ne devrait pas être aban-
donné, sauf avis contraire du médecin1.
Réactions
indésirables
Placebo
(N=2 875)
Dronédarone
400 mg
2 f.p.j
(n = 3 282)
Troubles
gastro-intestinaux
Diarrhée
Nausée
Douleurs abdominales
Vomissements
Dyspepsie
5,8 %
Troubles généraux
et touchant le point
d’administration
Fatigue
Asthénie
Troubles cardiaques
Bradycardie
Troubles cutanés et
sous-cutanés
Éruptions cutanées
(notamment de type
généralisé, maculaire
et maculopapuleux)
Prurit
Adapté de la monographie de produit de MULTAQ.
Fréquence d’une première hospitalisation pour
cause d’affection cardiovasculaire ou de mortalité
toutes causes confondues

Peut-on augmenter progressivement la dose
de MULTAQMC pour éviter les effets
secondaires gastro-intestinaux?
À ce jour, aucune expérience n’a été réalisée sur
l’augmentation progressive de la dose. La dose
recommandée est de 400 mg deux fois par jour
chezl’adulte.MULTAQMC doit être pris à raison
d’un comprimé de 400 mg deux fois par jour, au
petit-déjeuner et au souper1.
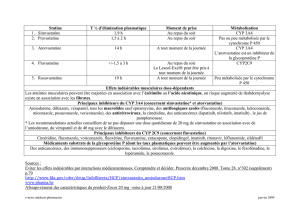
Y a-t-il des interactions médicament-
médicament, médicament-aliment, médica-
ment-herbe médicinale avec MULTAQMC?
Interactions médicament-médicament
La dronédarone, dont la biotransformation dépend
principalement de la CYP 3A4, est un inhibiteur
modéré de la CYP 3A4 et un inhibiteur léger de la
CYP2D6.Parconséquent,lesagentsquiinhibent
ou induisent la CYP 3A4 peuvent interagir avec la
dronédarone, et la dronédarone peut interagir avec
les produits médicinaux qui sont des substrats de
la CYP 3A4 et de la CYP 2D6. La dronédarone
peut aussi inhiber le transport de la P-glycoprotéine
(P-gP). Cependant, elle ne risque pas d’inhiber
significativementlesisoenzymesCYP1A2,CYP2C9,
CYP 2C19, CYP 2C8 et CYP 2B6. Il existe
également un risque d’interaction pharmaco-
dynamique entre la dronédarone et les bêtabloquants,
les antagonistes du calcium et les digitaliques1.
L’administration concomitante de dronédarone
et de médicaments qui prolongent l’intervalle QT
(comme les phénothiazines, le bépridil, les anti-
dépresseurs tricycliques, certains macrolides oraux
et les antiarythmiques des classes I et III, qui
peuvent induire des torsades de pointes) est contre-
indiquée en raison du risque d’effet proarythmique
que comportent ces associations1.
Au cours des essais cliniques, les patients
traités par la dronédarone ont reçu divers médi-
caments en concomitance, notamment des
bêtabloquants, des digitaliques, des antagonistes
du calcium (y compris des agents ayant pour
effet de diminuer la fréquence cardiaque), des
statines et des anticoagulants oraux1.
Pour la liste complète des interactions médi-
cament-médicament établies ou potentielles, con-
sulter le tableau 3 de la monographie de produit1.
Interactions médicament-aliment
Jus de pamplemousse : la consommation répétée
de 300 mL de jus de pamplemousse (un inhibiteur
de la CYP 3A4), trois fois par jour, a multiplié par
trois l’exposition à la dronédarone. Par conséquent,
il faut aviser les patients de ne pas consommer
de boissons contenant du jus de pamplemousse
lorsqu’ils prennent de la dronédarone1.
Interactions médicament-herbes médicinales
L’administration concomitante de dronédarone
et de millepertuis, qui est un puissant inducteur
de la CYP 3A4, n’est pas recommandée, étant
donné que le millepertuis diminue l’exposition à
la dronédarone1.
En résumé
MULTAQMC est indiqué pour le traitement des
patients qui présentent ou qui ont déjà présenté
une fibrillation auriculaire, afin de réduire le risque
d’hospitalisation pour cause d’affection cardiovas-
culaire attribuable à la fibrillation auriculaire1.
L’emploi de MULTAQMC est contre-indiqué
chez les patients qui souffrent d’insuffisance car-
diaque congestive (ICC) grave (de stade IV selon
la NYHA) ou d’une autre affection entraînant un
état hémodynamique instable. MULTAQMCdoit
être administré avec prudence aux patients
atteints d’ICC modérée (de stade III selon la
NYHA) et seulement si l’on juge que les bienfaits
escomptés l’emportent sur les risques. L’emploi
de MULTAQMC estaussicontre-indiquéchezles
patients qui présentent un bloc auriculo-ventri-
culaire du deuxième ou du troisième degré, ou une
maladie du nœud sinusal (sauf s’il est utilisé con-
jointement avec un stimulateur cardiaque qui fonc-
tionne);chezlespatientsquisouffrentdebradycar-
die(<50bpm);chezlespatientsquiprésententun
intervalle QTc ≥ 500 ms calculé selon la formule
deBazettenprésenced’uneinsuffisancehépatique
grave; durant la grossesse; durant l’allaitement;
chezlespatientsquiontdéjàprésentédesréactions
d’hypersensibilité à la dronédarone ou à l’un des
composants du produit ou du contenant1.
MULTAQMCnedoitpasêtreadministréchez
les patients qui prennent en concomitance de
puissants inhibiteurs de la CYP 3A4 tels que le
kétoconazole, l’itraconazole, le voriconazole, la
cyclosporine, la télithromycine, la clarithromycine,
la néfazodone et le ritonavir. L’administration
concomitante de dronédarone et de médicaments
qui prolongent l’intervalle QT (par exemple, les
phénothiazines,lebépridil,lesantidépresseurstri-
cycliques, certains macrolides administrés par voie
orale et les antiarythmiques de classes I et III, qui
peuvent induire des torsades de pointes) est contre-
indiquée en raison du risque d’effet proarythmique
que comportent ces associations. On doit mettre
fin au traitement par les antiarythmiques de classe
I ou III (tels que la flécaïnide, la propafénone, la
quinidine, le disopyramide, le dofétilide, le sotalol
et l’amiodarone) avant d’amorcer le traitement par
MULTAQMC 1.
Les effets indésirables les plus souvent observés
chez les patients ayant reçu MULTAQMC à
400mg,2foisparjour,étaientladiarrhée(9,0%),
lesnausées(4,9%),lafatigue(4,3%),lesdouleurs
abdominales (3,5 %), la bradycardie (3,3 %), les
éruptions cutanées (notamment de type généralisé,
maculaire et maculopapuleux) (2,7 %), l’asthénie
(2,3 %), les vomissements (2,0 %), la dyspepsie
(1,5%)etleprurit(1,3%)1.
Il est recommandé d’établir les valeurs initiales
de la créatinine plasmatique 7 jours après la mise
en route du traitement par la dronédarone. Si les
résultats obtenus pour la créatinine plasmatique
lors de l’épreuve de laboratoire se situent au-dessus
de la limite supérieure de la normale, il faut utiliser
cette nouvelle mesure comme valeur de référence
en tenant compte du fait qu’une telle élévation est
prévisible avec la dronédarone, étant donné que ce
médicament peut influer sur les valeurs initiales.
Une élévation de la créatininémie ne commande pas
nécessairement l’interruption du traitement par la
dronédarone ni par les inhibiteurs de l’ECA ou les
antagonistes des récepteurs de l’angiotensine (ARA)1.
La réalisation d’épreuves de laboratoire subséquentes
est à la discrétion du médecin traitant1.
Prière de consulter la monographie de MULTAQMC
pour obtenir des renseignements sur la sélection
des patients, la posologie, les mises en garde et les
précautions qui se rapportent à MULTAQMC à
l’adresse suivante : www.sanofi-aventis.ca.
Références:
1. Monographie de produit de MULTAQMC, sanofi-aventis
Canada Inc., 31 juillet 2009.
2. Hohnloser SH et coll. Effect of dronedarone on cardiovascular
events in atrial fibrillation. New Engl J Med, 2009;360:668-78.
3. Singh BN et coll. Dronedarone for maintenance of sinus
rhythm in atrial fibrillation or flutter. New Engl J Med,
2007;357:987-99.
4. Tschuppert Y et coll. Effect of dronedarone on renal function
in healthy subjects. Br J Clin Pharmacol, 2007;64:785-91.
MULTAQMC est une marque de commerce
de sanofi-aventis.
Q&R est publié par Les Éditions Rogers Limitée,
1200, avenue McGill College, bureau 800, Montréal (Québec) H3B 4G7.
Tél. : 514 843-2569, Téléc. : 514 843-2183. Ce Q&R ne peut être reproduit,
en tout ou en partie, sans l’autorisation écrite de l’éditeur. © 2010
Veuillez consulter le résumé des
renseignements posologiques
1
/
4
100%