TSChimiePartie B

Chimie Partie B : LA TRANSFORMATION D’UN SYSTEME CHIMIQUE
EST-ELLE TOUJOURS TOTALE ?
1/2
couple Acide / Base
demi-équation protonique : A = H
+
+ B
Lors d’une réaction acido-basique, l’ion hydrogène (ou proton) perdu
par l’acide A
1
est gagné par la base B
2
; on obtient les espèces
conjuguées B
1
et A
2
.
Exemples de solutions aqueuses à connaître ♥ :
acide chlorhydrique (H
3
O
+(aq)
+ Cl
-(aq)
) H
3
O
+(aq)
/ H
2
O
(l)
d’acide nitrique (H
3
O
+(aq)
+ NO
3-(aq)
)
H
3
O
+(aq)
/ H
2
O
(l)
d’acide sulfurique (2 H
3
O
+(aq)
+ SO
42-(aq)
) H
3
O
+(aq)
/ H
2
O
(l)
d’acide éthanoïque CH
3
COOH
(aq)
CH
3
COOH
(aq)
/ CH3COO
-(aq)
d’hydroxyde de sodium (Na
+(aq)
+ HO
-(aq)
) H
2
O
(l)
/ HO
-(aq)
d’hydroxyde de potassium (K
+(aq)
+ HO
-(aq)
) H
2
O
(l)
/ HO
-(aq)
d’ammoniac NH
3(aq)
NH
4+(aq)
/ NH
3(aq)
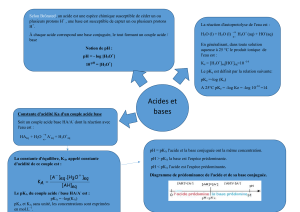
RAPPELS
taux d’avancement final d’une transformation :
max
f
xx
f
τ
=
τ
f
= 1 : transformation totale
τ
f
< 1 : transformation limitée : le système chimique est
à l’état d’équilibre (microscopiquement, deux réactions
inverses simultanées à la même vitesse ;
macroscopiquement, plus d’évolution apparente ; on
parle d’équilibre dynamique)
ex.
CH
3
COOH
(l)
+ H
2
O
(l)
= CH3COO
-(aq)
+ H
3
O
+(aq)
Savoir relier
τ
f
et donc x
f
(ou x
eq
) à la mesure
de pH ou de σ à l’équilibre
En solution aqueuse : a R1 + b R2 = c P1 + d P2
quotient de réaction à l’instant t pour la transformation chimique considérée :
nombre sans dimension
ba
dc
r
[R2] [R1] [P2] [P1]
Q=
sans unité
avec [P] = [P
(aq)
] concentration effective de l’espèce dissoute P en mol.L
-1
= 1 si P est solide ou si P est le solvant (eau en solution aqueuse) …..
A l’équilibre : Q
r , eq
= K constante d’équilibre de la réaction considérée,
dépendant de la température mais pas des concentrations initiales.
Pour une transformation donnée,
τ
f
dépend de la constante d’équilibre K de la
réaction et des concentrations initiales.
constante d’acidité K
A
du couple A/B :
constante d’équilibre de la réaction de l’acide A sur l’eau :
A
(aq)
+ H
2
O
(l)
= B
(aq)
+ H
3
O
+(aq)
]A[
]B][O
3
H[
A
K
+
=
•
à c fixé,
τ
f
croît avec K
A
[H
3
O
+
]
eq
croît avec K
A
pH décroît quand pK
A
= - log K
A
décroît
plus K
A
est grand, plus pK
A
est petit, et plus l’acide est fort
( plus la base conjuguée est faible )
•
à K
A
fixé,
τ
f
croît quand c décroît
(1): a R1 + b R2 = c P1 + d P2
⇒
K
1
(2): c P1 + d P2 = a R1 + b R2 ⇒ K
2
K
2
=
K
1
-1
= 1 / K
1
Savoir relier
τ
f
à K et aux n
i
( )
Savoir déterminer K par la mesure
Réaction acido-basique entre l’acide A
1
(A
1
/ B
1
: K
A1
) et la base B
2
(A
2
/ B
2
: K
A2
) :
A
1 (aq)
+ B
2 (aq)
= B
1 (aq)
+ A
2 (aq)
⇒ K =
2A
1A
K
K
Réaction d’autoprotolyse de l’eau :
2 H
2
O
(l)
= HO
-(aq)
+ H
3
O
+(aq)
produit ionique de l’eau : K
e
= 1,0.10
-14
à 25°C
Dans toute solution aqueuse : [H
3
O
+
].[ HO
-
] = K
e
Une solution aqueuse est toujours électriquement neutre.
Lorsque son pH vaut 7, elle est neutre du point de vue
acido-basique et [H
3
O
+
] = [ HO
-
] = 1,0.10
-7
mol.L
-1
.
[H
3
O
+
] > [ HO
-
]
[H
3
O
+
] < [ HO
-
]
solution acide solution basique
7
pH
Dans une solution aqueuse diluée :
pH = - log [H
3
O
+(aq)
] ou [H
3
O
+(aq)
] = 10
– pH
avec
[H
3
O
+(aq)
] : nombre égal à la valeur de la
concentration de la solution en ions oxonium
exprimée en mol.L
-1
log : fonction logarithme décimal
pH : nombre sans dimension et sans unité
compris entre 0 et 14 à 25°C
On utilise un indicateur coloré ou du papier-pH
pour estimer le pH d’une solution aqueuse.
On mesure le pH d’une solution aqueuse à l’aide
d’un pHmètre.
pH
[H3O
+
(aq)]
0 14 5
10
-
5
mol.L
-
1
= 0,000 01 mol.L
-
1
3
10
-
3
mol.L
-
1
= 0,001 mol.L
-
1

Couple acide /base A / B : pK
A
= pH – log
]A[
]B[
⇒ pH = pK
A
+ log
]A[
]B[
Domaines de prédominance :
[A] > [B] [B] > [A]
A prédomine B B prédomine devant A
pK
A
pH
Un indicateur coloré acido-basique est un couple acide/base dont les formes acide et basique conjuguées
n’ont pas la même couleur en solution aqueuse. La teinte sensible, due à la coexistence des deux formes,
s’obtient dans une zone de pH encadrant le pK
A
de l’indicateur (zone de virage).
Indicateurs colorés Teinte
forme acide Zone de virage Teinte
forme basique
Hélianthine rouge 3,1 – 4,4 jaune
Bleu de bromothymol jaune 6,0 – 7,6 bleu
Phénolphtaléine incolore 8,2 - 10 rose
Titrage acido-basique : voir
réactif titrant : HO
-(aq)
si le réactif à titrer est un acide.
réactif titrant : H
3
O
+(aq)
si le réactif à titrer est une base.
conductimétrique : on observe l’évolution de G ou de σ en fct du volume de solution titrante versée ;
on détermine graphiquement le point d’équivalence.
colorimétrique : on observe le changement de couleur provoqué par le virage d’un indicateur coloré acido-basique
choisi de sorte que sa zone de virage contienne le pH à l’équivalence.
pH-métrique : on observe l’évolution du pH en fct du volume de solution titrante versée ;
on détermine graphiquement le point d’équivalence (saut de pH aux alentours de E) :
Méthode des tangentes Extremum de la fonction dérivée
vd
pH d
Titrage acido-basique
0,00
2,00
4,00
6,00
8,00
10,00
12,00
14,00
0 5 10 15 20 25 30
Vb (mL)
pH
E
pH
E
Titrage acido-basique
0,00
2,00
4,00
6,00
8,00
10,00
12,00
14,00
0 5 10 15 20 25 30
Vb (mL)
pH
E
pH
E
Diagramme de distribution, en
fonction du pH, des différentes
espèces chimiques des deux
couples acide/base proposés :
CO
2
, H
2
O / HCO
3-
et HCO
3-
/
CO
32-
:
pK
A
(CO
2
, H
2
O / HCO
3-(aq)
) = 6,4
pK
A
(HCO
3-(aq)
/ CO
32-(aq)
) = 10,3
1
/
2
100%