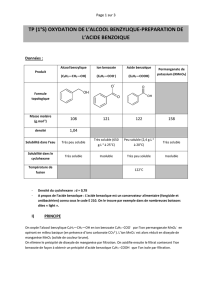
Synthèse de l`acide benzoïque

1ere S Évaluation de travaux pratiques
Synthèse de l'acide benzoïque 2008-2009
Objectifs du TP :
➢Réaliser au laboratoire la synthèse d'un conservateur (additif alimentaire) : l'acide benzoïque.
➢Mettre en œuvre les technique de chauffage a reflux, de filtration, de séchage.
➢Déterminer le rendement de la synthèse.
➢Rédiger un compte rendu par binôme de vos expériences.
Mode opératoire de la synthèse :
Remarque : La synthèse nécessite le port de gants et de lunettes. Les réactifs utilisés étant pour
certains très inflammables, on veillera à les éloigner de toute flamme et toute source de chaleur.
•Dans un ballon bicol de 250 mL, introduire à l'aide d'une pipette graduée, un volume
V0 = 1,0 mL d'alcool benzylique. Puis à l'aide d'une éprouvette graduée, introduire 20 mL
d'une solution de soude à 2 mol.L-1, ainsi que quelques grains de pierre ponce.
•Disposer l'ensemble dans un montage de chauffage à reflux, et adapter une ampoule de
coulée dans laquelle vous verserez 60 mL de solution aqueuse de permanganate de
potassium (K+ ; MnO4-)(aq) de concentration 0,25 mol.L-1.
•Chauffer le mélange à reflux, puis introduire très lentement la solution oxydante
(K+ ; MnO4-)(aq) tout en maintenant le chauffage. Un précipité marron apparaît, c'est le
dioxyde de manganèse MnO2, formé par réduction des ions permanganate par l'alcool
benzylique.
•Une fois l'addition de la solution oxydante terminée, poursuivre le chauffage pendant
environ 10 minutes. Cesser alors le chauffage tout en maintenant la circulation d'eau
dans la réfrigérant.
•Pour réduire, les ions permanganate en large excès, on ajoute par l'ampoule de coulée
quelques mL d'éthanol, jusqu'à disparition de la couleur violette de la phase liquide.
•Retirer le ballon du montage a reflux et le refroidir à l'eau.
•Filtrer le contenu du ballon, le filtrat doit-être limpide et pratiquement incolore.
•Verser le filtrat dans un bécher placé dans la glace. Ajouter avec précaution 8 mL d'une
solution d'acide chlorhydrique concentré : un précipité blanc d'acide benzoïque apparaît.
Attendre quelques minutes que la cristallisation de l'acide benzoïque soit complète, puis
filtrer le mélange (on pourra utiliser dans la mesure du possible une filtration a pression
réduite).
•Rincer le mélange à l'eau distillée, le sécher (avec du sopalin) et le déposer sur un verre
de montre. Mettre le tout à l'étuve pour séchage (environ 20 minutes).
•Une fois sec, le peser et noter la masse mexp d'acide benzoïque synthétisé.

Questions :
A effectuer pendant le chauffage à reflux :
1- A quelles familles appartiennent l'alcool benzylique et l'acide benzoïque ? Justifier en entourant dans
leurs formules topologiques le groupe fonctionnel caractéristique.
2- A quelle classe appartient l'alcool benzylique. Justifier votre réponse.
3- Écrire les deux demi-équations en milieu acide, correspondantes aux couples MnO4- / MnO2 (ion
permanganate / dioxyde de manganèse) et C7H6O2 / C7H8O (acide benzoïque / alcool benzylique)
4- En déduire l'équation bilan de la réaction entre l'ion permanganate et l'alcool benzylique en milieu
acide.
En réalité la synthèse de l'acide benzoïque a lieu en milieu basique et conduit donc a la formation de
l'ion benzoate (base conjuguée de l'acide benzoïque). On admettra que l'équation bilan de la réaction
dans le ballon est :
4 MnO4-(aq) + 3C7H8O(l) 4MnO2(s) + 4H2O(l) + HO-(aq) + 3C7H5O2-(aq)
Question bonus : (A ne faire en fin de TP que s'il vous reste du temps)
Écrire les demi-équations d'oxydoréduction en milieu basique des couples MnO4- / MnO2 (ion
permanganate / dioxyde de manganèse) et C7H5O2- / C7H8O (ion benzoate / alcool benzylique).
En déduire alors l'équation bilan écrite ci-dessus.
A effectuer après le travail de récupération de l'acide benzoïque :
5- Pour quelle raison ajoute-t-on de la pierre ponce au milieu réactionnel ?
6- Calculer les quantités de matières initiales d'alcool benzylique nalcool et de permanganate nMnO4-
introduites dans le ballon.
7- Il persiste une teinte violette après chauffage. Montrer que l'ion permanganate a été introduit en excès.
En déduire la valeur de l'avancement maximal de la réaction xmax.
8- En déduire la quantité de matière nacide et la masse mthéo d'acide benzoïque obtenue à l'état final. (On
admettra que la quantité de matière d'acide benzoïque produite est égale a la quantité de matière d'ions
benzoate formé par la réaction de synthèse)
9- Le rendement de la synthèse est défini comme le rapport de la masse de produit obtenu
expérimentalement par la masse théorique que l'on aurait du obtenir a l'état final. Il s'exprime en %.
= mexp
mtheo
Calculer le rendement de votre synthèse.
10- La synthèse s'effectuant en milieu basique, l'oxydation de l'alcool benzylique ne conduit pas à la
formation de l'acide benzoïque, mais de sa base conjuguée l'ion benzoate ( C6H5CH2O-). Justifier alors
l'intérêt de verser de l'acide chlorhydrique (H3O+ , Cl-) concentré pour faire précipiter l'acide benzoïque.
11- Écrire l'équation bilan de la réaction entre l'ion benzoate et l'acide chlorhydrique. On donne les
couples acide/base :
acide benzoïque / ion benzoate : C6H5CH2OH / C6H5CH2O-
ion oxonium / eau : H3O+ / H2O
1
/
2
100%