Conférence d`Internat n°1

Conférence d’Internat n°6 :
Macrolides, Sulfamides, Cyclines, Quinolones,
Antituberculeux, Antifongiques, Antiparasitaires
1) Quels sont les 3 familles d’antibiotiques apparentés aux macrolides ?
Quel est l’intérêt principal de chaque famille par rapport aux macrolides ?
On parle souvent du groupe des MLS voire maintenant des MLSK pour Macrolides, Lincosamide,
Synergistine (ou Streptogramines) et Kétolides
Lincosamides : un des principaux intérêts des Lincosamides par rapport aux macrolides est leur
utilisation par voie injectable. Ces molécules sont par exemple utilisées pour bloquer très rapidement la
synthèse protéique de certaines bactéries …. Par exemple au cours d’un choc toxinique à S. aureus
(TSST) ou à S. pyogenes, le traitement de référence inclus généralement de la Clindamycine.
Synergistine : comme leur nom l’indique, chaque spécialité de cette famille incluse 2 molécules qui
agissent en synergie. On a donc un spectre généralement plus large de ces molécules (les bactéries
devant être résistantes aux 2 à la fois) et surtout on passe d’une activité bactériostatique à une activité
bactéricide.
Une des principales applications de cette famille est l’utilisation de la Pyostacine® : pristinamycine
comme anti-staphylococcique (elle reste souvent active même sur les SARM)
Kétolides :
La Télithromycine (Ketec®) est arrivée sur le marché car les méchantes petites bactéries avaient une
facheuse tendance à devenir résistante aux macrolides : résistance acquise par modification de la cible.
La bactérie produit une enzyme qui vient méthyler (greffer un groupe CH3) sur son ribosome, ce qui
bloque la fixation des macrolides, des lincosamides et d’un des 2 composants des synergistines (qui
restent active mais deviennent bactériostatiques).
Eh ben, la télithromycine, elle est plus maligne que tout le monde !!! Elle se fixe à 2 endroits sur la sous
unité 50S du ribosome bactérien, donc même si le ribosome est muté, il lui reste une de ses 2 fixations
et donc elle reste active.
2) D’un point de vue de leur structure chimique, les macrolides peuvent
être classés en différents groupes : lesquels ? Donnez un exemple par groupe.
Les macrolides sont classés en fonction de la taille de leur macrocycle :
14 atomes : érythromycine, roxithromycine, dirithromycine, clarithromycine
15 atomes : Azithromycine que l’on appelle parfois aussi les Azalides (« az » est le préfixe utilisé pour
signaler la présence d’un atome d’azote dans le cycle)
16 atomes : spiramycine, josamycine
Conférence d’internat n°6 : Macrolides, sulfamides, cycline, fluoroquinolones, antifongiques, antiparasitaires
[email protected] 1/12

3) Expliquez les principales caractéristiques pharmacocinétiques des
macrolides. En déduire les applications ou les limites de leur utilisation en
thérapeutique
Les macrolides, les synergistines et les kétolides sont utilisés par voie orale, les lincosamides par voie
injectable
Conférence d’internat n°6 : Macrolides, sulfamides, cycline, fluoroquinolones, antifongiques, antiparasitaires
[email protected] 2/12

Attention, l’érythromycine est facilement dégradée par l’acidité gastrique, on l’utilise donc par voie
injectable ou on utilise des dérivés par voie orale (ethyl succinate d’érythromycine …)
Les macrolides sont des grosses molécules qui diffusent très bien dans l’organisme mais franchissent
mal les barrières physiologiques : pas de passage dans le LCR, pas d’élimination urinaire (donc bien
sûr, pas d’utilisation possible pour les méningites ou les infections urinaires ….)
De la même façon, ils ont du mal à franchir la membrane externe des Gram négatif et sont donc plutôt
des antibiotiques dirigés contre les Gram positif (attention, il marche quand même très bien sur certains
Gram nég comme H. influenzae)
Ils se fixent en partie aux protéines plasmatiques mais pas assez pour provoquer des interactions
médicamenteuses
Ils sont métabolisés par le foie et éliminés par voie biliaire. Et évidemment, ce sont des inhibiteurs du
cytochrome P450 3A4 (sauf la spiramycine) donc attention aux interactions médicamenteuse (tout le
monde connait le fameux « ergotisme » : macrolide (sauf spiramycine) + ergotamine ou
dihydroergotamine …
Les macrolides bloque la métabolisation hépatique de l’ergotamine ou du dihydroergotamine, ce qui
provoque une augmentation des concentrations plasmatiques. Il faut donc retenir 2 signes importants :
- La vasoconstriction : surtout distale (doigts, orteils) : les symptômes sont la perte de
sensibilité, les oedèmes, la desquamation et cela peut évoluer jusqu’à la nécrose
- Les symptômes convulsifs : convulsions, spasmes, diarrhées, nausées, vomissements … et
cela peut aller jusqu’aux troubles psychiatriques et aux hallucination (l’ergotamine est un
précurseur du LSD …)
4) Reclasser toutes les familles d’antibiotiques en fonction de leur
potentiel bactériostatique ou bactéricide ? Quelles en sont les conséquences ?
Rappel :
- Il est fortement déconseillé d’utiliser des antibiotiques bactériostatiques chez les sujets dont
le système immunitaire n’est pas capable de détruire les bactéries (sujets greffés, sidéens,
hémopathies malignes …).
- Il faut aussi éviter d’utiliser des antibiotiques bactériostatiques dans les infections graves :
méningites, septicémies …
- Il y a un antagonisme entre les antibiotiques bactériostatiques et les antibiotiques qui
agissent sur une phase de la division cellulaire comme les béta-lactamines.
5) Parmi les antibiotiques de ce piquage, lesquels peut on donner à la
femme enceinte ? Pourquoi les autres sont ils contrindiqués ?
Macrolides : OK
Sulfamides : contre-indiqués ….
Mais parfois on les utilise quand même : les risques pour l’enfant ne sont pas gravissimes : ex :
Conférence d’internat n°6 : Macrolides, sulfamides, cycline, fluoroquinolones, antifongiques, antiparasitaires
[email protected] 3/12
Bactériostatique Bactéricide
Macrolides Streptogramines, lincosamides
Cyclines Fluoroquinolones
Sulfamides Bactrim®
Ethambutol Rifampicine, isoniazide, pyrazinamide
Béta-lactamines, glycopeptides, aminosides

traitement de la toxoplasmose congénitale : pyriméthamine + sulfadiazine ou pyriméthamine +
sulfadoxine (en oubliant pas d’ajouter de l’acide folinique)
Cyclines : contre-indiqués chez la femme enceinte et l’enfant de moins de 8 ans : risque de coloration
permanente des dents ou d’hypoplasie de l’émail dentaire
Fluoroquinolones : contre indiqués chez la femme enceinte et l’enfant de moins de 15 ans : risque de
tendinopathie, de rupture du tendon d’Achille
6) Quel est le mécanisme d’action des sulfamides et quel est l’intérêt de
leur association avec des molécules de la famille des 2,4 diaminopyrimidine ?
Les sulfamides et les 2,4 diaminopyrimidine agissent en inhibant le cycle des folates. Les folates
interviennent dans la synthèse des bases puriques et pyrimidiques nécessaires à la création des acides
nucléiques (ARN et ADN).
L’intérêt réside dans le fait que ces 2 familles de molécules n’agissent pas sur la même enzyme du cycle
des folates : et, c’est un grand classique, quand on inhibe 2 enzymes de la même voie métabolique, on
obtient un effet synergique.
Les sulfamides agissent en bloquant la dihydroptéroate synthétase, alors que les 2,4 diaminopyrimidine
bloquent la dihydrofolate réductase.
Donc, alors que les sulfamides ont un rôle limité en tant qu’antibiotique (je vous rappelle qu’ils sont par
contre encore bien utilisés pour leur propriété hypoglycémiante), le cotrimoxazole (Bactrim®) reste une
molécule assez souvent prescrite.
Conférence d’internat n°6 : Macrolides, sulfamides, cycline, fluoroquinolones, antifongiques, antiparasitaires
[email protected] 4/12

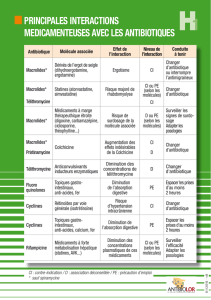
7) Classez les molécules de ce piquage en fonction de leur propriété à
induire ou inhiber les cytochromes hépatiques ?
Je vous ai mis ces 2 tableaux que j’ai trouvés sur le net : ne retenez que le cytochrome P450 3A4, les
autres on s’en tape.
Donc en gros, pour répondre à la question :
Macrolides, anti-fongiques azolés sont des inhibiteurs enzymatiques
Rifampicine est un inducteur enzymatique
Pour illustrer ce que je vous ai mentionné un peu plus haut, n’allez surtout pas me retenir que les
fluoroquinolones inhibent le CYP1A2 !!!
Par contre, vous pouvez rajouter la griséofulvine comme inducteur enzymatique et l’isoniazide et la
télithromycine comme inhibiteur enzymatique.
Conférence d’internat n°6 : Macrolides, sulfamides, cycline, fluoroquinolones, antifongiques, antiparasitaires
[email protected] 5/12
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%