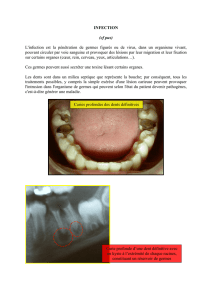
Résistance aux antibiotiques d`Escherichia coli chez des animaux

LU DANS :
Antibioticumresistentie in
Escherichia coli
bij
landbouwhuisdieren, hazen, septisch materiaal en
oppervlaktewater in Vlaanderen
(Résistance aux antibiotiques d’
Escherichia coli
isolés chez des
animaux domestiques destinés à la consommation humaine, de
lièvres, de matériel septique et des eaux de surface en Flandre)
C. Casteleyn, J. Dewulf, B. Catry, A. de Kruif, D. Maes. Vlaams Diergeneeskundig
Tijdschrift, 2006, 75, 23 - 30
Les auteurs de ce travail ont étudié la prévalence des résistances à 14 antibiotiques d’utilisation
fréquente en médecine vétérinaire et en médecine parmi des populations d’Escherichia coli
isolées de différents animaux producteurs de denrées alimentaires (porcs à l’engrais, bétail
laitier et poulets de chair), de lièvres sauvages, de matériel septique provenant de l’homme et
d’eaux de surface, dans trois régions de Flandre (Bruges, Deinze, Wingene avec respectivement
une densité de population animale faible, moyenne et élevée). L’influence de la densité de
population animale dans ces trois régions sur les prévalences de résistances a aussi été
examinée.
Le pourcentage de souches résistantes et la fréquence d’E. coli multirésistantes atteignaient leur
maximum chez les poules et les porcs élevés industriellement, en particulier pour les
antibiotiques fréquemment utilisés tels que les sulfamidés, les tétracyclines, la néomycine et la
streptomycine. Les poulets de chair présentaient davantage de résistance contre les quinolones
que les porcs à l’engrais. La prévalence de souches résistantes était peu importante chez le
bétail. Cette différence avec les deux autres espèces s’explique, selon les auteurs, par une
densité d’occupation plus petite (nombre d’animaux dans l’étable) et le risque de la présence
de résidus dans le lait. De faibles taux de résistance ont aussi été constatés chez les lièvres
sauvages. Enfin, les auteurs constatèrent des taux relativement élevés de résistance parmi les
souches isolées d’eaux de surface et de matériel septique, même s’ils émettent certaines
réserves quant à l’interprétation de ces derniers résultats.
Les densités respectives des populations animales des trois régions étudiées n’influaient pas
de manière statistiquement significative sur les taux de résistance des différentes populations
d’Escherichia coli.
Folia veterinaria

2
Reflection Paper on the use of fluoroquinolones in Food-
Producing Animals in the European Union: Development of
Resistance and impact on Human and Animal Health
(L’usage de fluoroquinolones chez les animaux producteurs de
denrées alimentaires dans l’UE: développement de résistance et
impact sur la santé humaine et animale)
EMEA/CVMP/SAGAM/184651/2005-CONSULTATION
Source: EMEA – CVMP (Committee for medicinal products for veterinary use)
Le CVMP s’est récemment penché sur la problématique de l’usage des fluoroquinolones en
médecine vétérinaire. Deux questions majeures ont été envisagées à la lumière des
informations récentes publiées à ce sujet. En quoi l’utilisation des fluoroquinolones chez les
animaux producteurs de denrées alimentaires peut-elle influencer l’apparition de résistances
chez les espèces bactériennes en médecine vétérinaire, en particulier chez les germes
zoonotiques jouant un rôle important aussi bien chez l’homme que chez l’animal ? Quel en est
l’impact sur la santé humaine et animale ?
Le premier élément souligné est le manque d’informations disponibles au sein de l’UE, sur
l’usage des quinolones et de leurs dérivés fluorés (FQ) chez les animaux destinés à la
consommation humaine. Les données statistiques montrent que non seulement le nombre des
FQ commercialisées dans les différents pays de l’UE diffère, mais aussi que les indications
pour l’utilisation de ces produits ne sont pas homogènes et les quantités administrées varient
fortement. Par ailleurs, il n’existe pas de recommandations uniformisées pour l’usage prudent
de ces substances ou des médicaments antimicrobiens en général. En médecine humaine, des
variations importantes entre les Etats membres sont constatées du point de vue des quantités
d’antibiotiques et des classes pharmacologiques utilisées. La résistance des pathogènes
humains aux substances antimicrobiennes, dont les FQ, montre aussi une grande variabilité
géographique.
Le document souligne que la plupart des résistances antimicrobiennes apparaissant en
médecine humaine ne peuvent pas être imputées à l’usage de ces produits en médecine
vétérinaire. L’émergence des résistances aux antibiotiques chez l’homme est fortement corrélée
avec leur usage en médecine humaine ainsi que le montrent plusieurs publications, consacrées
à ce sujet. Néanmoins, cette constatation ne doit pas occulter l’impact de l’usage des FQ en
médecine vétérinaire sur la santé humaine via les germes zoonotiques.
Après avoir rappelé les mécanismes de résistance contre les FQ et les « breakpoints » utilisés
pour définir les niveaux de sensibilité des germes, le texte traite de l’influence des FQ
administrées aux animaux producteurs de denrées alimentaires sur la sélection de facteurs de
résistances chez les germes pathogènes susceptibles de contaminer l’homme via la chaîne
alimentaire.
En médecine vétérinaire, l’introduction et l’usage des FQ au cours des décennies 80 et 90,
furent suivis par une résistance antimicrobienne accrue de Campylobacter et de Salmonella chez
les animaux producteurs de denrées alimentaires mais aussi chez l’homme. Se référant à de
nombreuses publications, le CVMP constate que ces résistances peuvent effectivement être
mises en relation avec l’usage de FQ en médecine vétérinaire. Les données épidémiologiques
relatives à la présence de ces germes et l’usage des FQ en médecine humaine permettent de

3
conclure que, dans ce cas particulier, les résistances constatées chez les patients humains
proviennent vraisemblablement d’un transfert de l’animal vers l’homme.
Dans les pays développés, les infections humaines à Campylobacter et Salmonella résultent de la
consommation d’aliments contaminés. Les animaux destinés à la consommation humaine
formant un réservoir pour ces germes, les denrées alimentaires issues de ces animaux
constituent la source de contamination principale pour l’homme. Des études épidémiologiques
et microbiologiques ont démontré que des Salmonella résistantes à l’acide nalidixique et des
Campylobacter résistants aux FQ étaient sélectionnés chez les animaux producteurs de denrées
alimentaires et se propageaient par la suite vers l’homme. Des publications récentes
démontrent la transmission possible d’E. coli résistants issus d’animaux producteurs de
denrées alimentaires vers l’homme. Jusqu’ici, on admettait que les E.coli humains et animaux
appartenaient à des populations différentes, et que les souches animales, à l’exception d’E. coli
O157:H7 et d’autres sérotypes d’ E. coli zoonotiques produisant des vérotoxines (Shiga-like
toxines), n’engendraient pas d’infections chez l’homme.
Les résistances aux antimicrobiens chez certaines souches de Salmonella et de Campylobacter
sont la cause de maladies plus sévères chez l’homme. En règle générale, les infections gastro-
intestinales aiguës non compliquées ne sont pas traitées par des médicaments antimicrobiens,
sauf chez les patients à risque. Lorsque des médicaments antimicrobiens s’avèrent nécessaires
pour le traitement des infections à Salmonella et Campylobacter, des FQ et des macrolides sont
respectivement utilisés. Des alternatives existent, notamment les céphalosporines pour
contrôler les Salmonella résistantes aux FQ. La résistance aux macrolides reste relativement rare
chez les Campylobacter. Les FQ sont, dans ce cas, utilisées. Les multirésistances peuvent être
responsables, selon le type de germes, d’un allongement de la durée des pathologies, d’un
accroissement du nombre d’hospitalisations et d’une mortalité accrue par rapport aux
affections induites par des germes sensibles. L’usage des antibiotiques pour des indications
visant d’autres systèmes que le tube digestif chez l’homme, par exemple le système
respiratoire, peuvent augmenter le risque d’infection gastro-intestinale par des germes
résistants à ces antibiotiques.
En médecine vétérinaire, l’échec de l’antibiothérapie liée à l’émergence de résistances entraîne
également, en fonction de la gravité des infections, une mortalité accrue lorsque aucun
traitement alternatif n’est disponible. Ceci ne concerne pas uniquement les germes zoonotiques
mais beaucoup d’autres bactéries chez l’animal. Un certain nombre de ces germes pathogènes
présentent des résistances multiples envers d’autres antimicrobiens que les FQ. La thérapie de
ces infections est par conséquent menacée si les FQ perdent leur efficacité du fait de leur usage
non contrôlé en médecine vétérinaire. Cette situation critique est une source d’altération du
bien-être et de la santé des animaux et s’accompagnera de pertes économiques accrues. Le
scénario est assez comparable en médecine humaine où les FQ peuvent jouer un rôle clé dans le
traitement d’infections sévères et invasives, engendrées par des germes pathogènes spécifiques
à l’espèce humaine.
Finalement, un certain nombre de recommandations sont formulées pour sauvegarder l’activité
des FQ et préserver la santé humaine et animale. L’usage de FQ comme médicaments de
deuxième ligne est recommandé, c’est-à-dire, exclusivement dans les cas où une réponse
négative à d’autres substances antimicrobiennes a été constatée ou est suspectée. Le recours
aux FQ pour la prévention doit être limité à des cas très spécifiques. Ces recommandations
devraient être mentionnées dans les notices (RCP) des spécialités contenant des FQ. La
posologie des FQ doit être déterminée sur base de leurs propriétés pharmacocinétiques et
pharmacodynamiques, afin d‘assurer une activité optimale et de réduire la pression de
sélection.

4
D’autres mesures sont proposées comme la diffusion continue d’informations à l’attention des
médecins vétérinaires, afin de les sensibiliser à la problématique de la résistance
antimicrobienne, la mise en place d’un plan de surveillance basé sur la déclaration et
l’enregistrement de l’usage des FQ et le monitoring de la résistance chez des pathogènes et des
germes indicateurs par espèce cible dans chaque Etat membre. Enfin, la promulgation par les
Etats membres de directives internationales concernant l’usage raisonné et prudent des
substances antimicrobiennes est recommandée.
Nous rappelons au lecteur l’article paru antérieurement dans le Folia Veterinaria: Les
Fluoroquinolones : la situation actuelle (Folia Veterinaria 2004 n° 3)
1
/
4
100%