L`air qui nous entoure

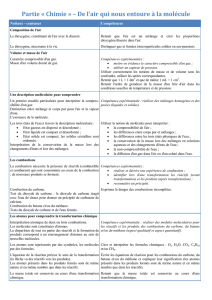
Partie CHIMIE: L’air qui nous entoure
Niveau 4ème
L’atmosphère terrestre
L’air est un mélange de plusieurs gaz. Les deux principaux gaz qui composent l’air sont le
dioxygène (environ 20 %) et le diazote (environ 80 %).
Le dioxygène est nécessaire à la vie de nombreux organismes, et de l’être humain en particulier.
L’air est constitué de molécules
En chimie, on appelle « corps pur » une substance qui n’est constituée que d’une seule sorte de
molécules.
Il y a plusieurs sortes de molécules dans l’air : l’air n’est donc pas un corps pur, c’est un mélange.
La molécule de dioxygène est faite de deux atomes d’oxygène.
Le symbole d’un atome d’oxygène est O et la formule d’une molécule de dioxygène est .
L’air est pesant
1 litre d’air pèse un peu plus de 1 gramme.
Cette valeur est à comparer à celle de 1 litre d’eau liquide, qui vaut environ 1 000 grammes (tu l’as
appris en classe de 5e).

La pression des gaz
Comprimer de l’air
Il est possible de comprimer un gaz, c’est-à-dire de réduire son volume en appuyant dessus. On dit
qu’un gaz est compressible.
Lors de la compression d’un gaz, les molécules se rapprochent les unes des autres.
Mesurer la pression d’un gaz
La pression d’un gaz se mesure avec un manomètre. On trouve des manomètres, par exemple sur
les pompes destinées à gonfler les ballons, les pneus de voiture et de bicyclette, etc.
L’unité légale de pression est le pascal (en abrégé Pa).
Dans la vie quotidienne, les manomètres sont souvent gradués en bars : .
Peut-on comprimer de l’eau ?
L’état solide de l’eau est un état compact, ce qui signifie que les molécules sont au contact
les unes des autres. C’est aussi un état ordonné, ce qui veut dire que les molécules sont
disposées selon un motif géométrique régulier.
L’état liquide de l’eau est un état compact, mais désordonné (les molécules n’ont aucune
disposition régulière).
L’état gazeux de l’eau est un état dispersé, ce qui signifie que les molécules ne sont pas en
contact les unes avec les autres. C’est aussi un état désordonné.
L’eau liquide est incompressible car c’est un état compact : on ne peut pas rapprocher davantage
les molécules.
La vapeur d’eau est compressible car c’est un état dispersé : on peut rapprocher les molécules.
Lors d’un changement d’état, la masse se conserve car ce sont les mêmes molécules ; c’est seulement
leur disposition qui change.

La combustion du carbone
La combustion du charbon de bois
Comme toutes les combustions, la combustion du charbon de bois :
nécessite du dioxygène en quantité suffisante :
libère de l’énergie sous forme de chaleur.
Lors d’une combustion, des matières disparaissent et d’autres, nouvelles, se forment : une
combustion est donc une réaction chimique.
Dans la combustion du charbon de bois, les deux réactifs sont le charbon de bois et le dioxygène. Les
produits de la combustion sont les cendres et le dioxyde de carbone.
Le dioxyde de carbone est identifié par le test à l’eau de chaux.
L’équation de la combustion du charbon de bois est :
dioxygène + charbon de bois → cendres + dioxyde de carbone
La combustion du carbone pur
L’équation de la combustion du carbone pur est :
dioxygène + carbone → dioxyde de carbone
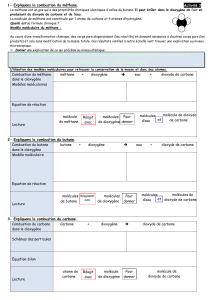
Les atomes et les molécules pour interpréter la combustion du carbone
pur
L’équation de la combustion du carbone se représente, avec les schémas d’atomes et de molécules :
L’équation de la combustion du carbone s’écrit, avec les formules moléculaires :
On peut l’écrire tout aussi bien :
Lors d’une réaction chimique, il y a « conservation des atomes ». Cela veut dire que l’on retrouve
exactement les mêmes atomes à la fin d’une réaction chimique (dans les produits de la réaction)
qu’au début (dans les réactifs).

La combustion du méthane
La combustion du méthane
Le méthane est le principal constituant du gaz naturel. Ce dernier est extrait de gisements
souterrains (la Russie et le Moyen-Orient, notamment, sont de grands producteurs de gaz naturel).
Quand la combustion du méthane donne une flamme bleue, on dit que cette combustion est
« complète ». Pour que la combustion soit complète, il faut que le dioxygène soit en quantité
abondante.
Si le dioxygène est en quantité insuffisante, la flamme est jaune : la combustion est
« incomplète ».
L’équation chimique de la combustion complète du méthane est :
méthane + dioxygène → dioxyde de carbone + eau
Les atomes pour comprendre la combustion du méthane
La formule chimique du méthane est
Pour qu’une équation chimique soit ajustée, il faut que les atomes présents dans les réactifs se
retrouvent intégralement dans les produits de réaction. On dit qu’il y a « conservation des atomes »
lors d’une réaction chimique.
C’est parce qu’il y a conservation des atomes lors d’une transformation chimique qu’il y a
conservation de la masse.
L’équation chimique ajustée de la combustion complète du méthane est :
Dans une équation chimique, les chiffres écrits en grand désignent des nombres de molécules.
Ceux écrits en petit et en bas désignent les nombres d’atomes dans les molécules.

La combustion du butane
Le butane a pour formule chimique
Lors de la combustion complète du butane, les produits de réaction sont les mêmes que lors de la
combustion complète du méthane : de l’eau et du dioxyde de carbone.
Il faut être capable d’ajuster une équation chimique, telle que celle de la combustion complète du
butane :
équation non ajustée :
équation ajustée :
 6
6
1
/
6
100%