Ds4 - Canalblog

Ds4 TS 16/01/2012
« Repérer ce qui mène au fondamental, délaisser délibérément le reste, toute cette
multitude de choses disparates qui encombrent d’habitude notre esprit et le détournent de
l’essentiel »
Albert Einstein (1879-1955 ) prix Nobel 1921.
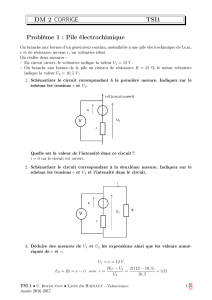
1) Système électrique oscillant
Nous étudions les oscillations libres d’un circuit R ,L,C . Dans un premier temps le
condensateur de capacité C =1F est chargé sous une tension constante E = 10 V.
Un fois chargé nous mettons ce condensateur en circuit avec une bobine
d’inductance L que nous allons déterminer et un conducteur ohmique R .
1) Sur le schéma de ce montage, en respectant le sens du courant imposé, tracer les
flèches tension aux bornes du condensateur et de la bobine en convention récepteur.
Nous supposons que la résistance totale R n’est pas négligeable.
2) q représentant la charge électrique de l’armature A du condensateur, donner la
relation entre q(t) et i(t) et celle qui existe entre q(t) et uC(t) .
En déduire la relation qui existe entre i(t) et uC(t).
3) Donner la relation entre ub(t) et i(t) et celle entre uR(t) et i(t).
4) En utilisant la loi d’additivité des tensions, établir que l’équation différentielle régissant
l’évolution temporelle de la tension uc aux bornes du condensateur s’écrit :
( )
0=u
LC
1
+
dt
du
Lr+R
+
dtud C
C
2C
2
5) Dans l’hypothèse où la résistance R+r est nulle, montrer que la fonction
uC(t) = Acos(Bt), où A et B sont des constantes, est solution de cette
équation différentielle si B a une expression qu’on déterminera.
6) Quelle est la valeur de uC à t = 0 s ? A partir de cette condition initiale, déterminer la
valeur de la constante A.
7) Déduire de la question 5 l’expression de la période propre T0 des oscillations.
Vérifier que l’expression trouvée pour T0 a la dimension d’une durée.
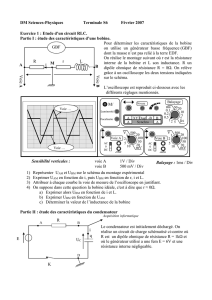
8) En réalité, la résistance n’est pas négligeable ? Nous observons l’oscillogramme
suivant pour uc( t ) : (document 1)
i
q
A
B
D
ub
uR

8.1) Déterminer graphiquement la valeur de la pseudo-période T.
8.2) Nous supposerons que T = T0. En déduire la valeur de l’inductance L de la
bobine.
8.3) Nous observons sur le document 2 les énergies EL(t) et EC(t) emmagasinées
respectivement dans la bobine et dans le condensateur ainsi que la somme
E(t) = EL(t) + EC(t) au cours du temps. Rappeler les expressions de EL(t) , EC( t ) .
8.4) Attribuer (sans justification) à chacune des trois courbes a, b et c du graphe
document 3 les énergies EL(t), EC(t) et E(t).
8.5) Que pouvez-vous dire de l’évolution de E(t) ? Proposer une explication au
phénomène observé.
-10
-5
0
5
10
0 1 2 3 4 5
t (ms)
(V)
Uc
(document 1)
-10
0
10
20
30
40
50
60
0 1 2 3 4 5
t (ms)
E(µJ)
(document 2 )
EXERCICE 2 : De la vitamine C dans la rose
Le fruit de la rose ou de l’églantier est nommé cynorhodon. Il est très utilisé en
phytothérapie pour prévenir la fatigue et renforcer les défenses immunitaires. Il contient
des tanins, les vitamines A et B et il est aussi très riche en vitamine C ou acide
ascorbique. On trouve en pharmacie de l’extrait de cynorhodon sous forme de gélules. La
formule de l’acide ascorbique est :
HOH2C
CHOH
C
O
C
HO
OH
C
C
O
H

Dans la suite de l’exercice, on notera l’acide ascorbique sous la forme AH, acide du
couple AH/A. On désire comparer l’apport en vitamine C d’une gélule de cynorhodon,
produit naturel, avec celui d’un comprimé de type Laroscorbine 500®, produit de
synthèse.Pour cela, on détermine par titrage, la quantité d’acide ascorbique présente
dans une gélule.
Protocole expérimental
On dissout dans l’eau, le contenu d’une gélule de cynorhodon dans une fiole jaugée de
100,0 mL.Puis, on réalise le titrage pH-métrique du contenu de la fiole à l’aide d’une
solution aqueuse d’hydroxyde de sodium de concentration molaire Cb = 0,10 mol.L1.
Données : MH = 1,0 g.mol1 ; MC = 12,0 g.mol1 ; MO = 16,0 g.mol1.
Questions
1. Calculer la masse molaire moléculaire de l’acide ascorbique notée MAH.
2. Écrire l’équation de la réaction support du titrage.
3. L’équivalence acido-basique.
3.1. Définir par une phrase l’équivalence acido-basique.
3.2. Donner la relation entre les quantités de matière des réactifs introduits à
l’équivalence.
4. Le suivi du titrage permet le tracé de la courbe fournie en annexe.
4.1. En précisant la méthode employée, déterminer les coordonnées du point
d’équivalence de ce titrage.
4.2. En déduire la quantité de matière en acide ascorbique nAH contenue dans une
gélule de cynorhodon.
4.3. En déduire la masse mAH d’acide ascorbique présente dans une gélule.
4.4. Un comprimé de Laroscorbine 500® contient 500 mg d’acide ascorbique. Quel est,
entre la gélule de cynorhodon et le comprimé de Laroscorbine, le composant le
plus riche en vitamine C ?

Exercice n°3 : TRAITEMENT DE L’EAU D’UNE PISCINE
La régulation du pH est essentielle dans le traitement de l’eau des piscines. En
permanence analysé grâce à une sonde puis corrigé par une pompe (par injection de
produit correcteur), le pH est maintenu à son niveau idéal (7,2 – 7,6).
Données :On considère toutes les solutions à 25°C
Couples acide/base : H3O+ (aq) / H2O ;
1
A
pK
= 0 H2O / HO – (aq) ;
2
A
pK
= 14
acide hypochloreux/ion hypochlorite : HClO(aq) /CIO – (aq) ;
3
A
pK
= 7,5
3.1. Lors d’un contrôle de pH, la sonde mesure la valeur pH = 8,5. Le pH de cette
eau, plus élevé que celui de l’humeur aqueuse de l’œil humain, est responsable de
l’irritation des yeux.
3.1.1. À ce pH, indiquer l’espèce prédominante du couple HClO(aq)/ClO –(aq).
3.1.2. Calculer le rapport des concentrations en ions hypochlorite et en acide
hypochloreux lors de ce contrôle (on ne cherchera pas à déterminer ces deux
concentrations).
3.2. Pour rétablir la valeur du pH au niveau « idéal », la pompe injecte 0,1mol d’acide
chlorhydrique dans l’eau de la piscine, sans variation notable du volume V de l’eau
contenue dans la piscine. L’équation de la réaction associée à la transformation qui se
produit est :
ClO –(aq) + H3O+(aq) = HClO(aq) + H2O (équation 3)
3.2.1. Exprimer la constante d’équilibre K de cette réaction en fonction de K A3 . Puis
calculer K.
3.2.2. L’état initial du système est défini ainsi :
le volume de l’eau de la piscine est V = 1,0105 L.
on introduit 0,10 mol d’ions H3O+ par ajout d’acide chlorhydrique.
le rapport
i
i
ClO
HClO
est égal à celui calculé au 3.1.2.
3.2.2.a. Calculer la concentration molaire effective initiale en ions H3O+ notée [H3O+]i .
3.2.2.b. Calculer le quotient de réaction initial Qr,i.
3.2.3. En appliquant le critère d’évolution spontanée, donner le sens d’évolution de la
réaction d’équation 3.
3.2.4. À partir de l’expression de la constante d’acidité
3
A
K
du couple acide
hypochloreux/ion hypochlorite et du rapport
i
i
ClO
HClO
calculé au 3.1.2., montrer que le pH
de l’eau de la piscine diminue.
JR K 27/05/2017 Travailler avec sérieux sans se prendre au sérieux ! ! ! !

Correction D.S n°4 TS 1 du 16/01/2011
Exercice n°1
Système électrique oscillant
Nous étudions les oscillations libres d’un circuit R,L,C .
Dans un premier temps le condensateur de capacité C = 1
F est chargé sous une
tension constante U0 = 10 V.
Une fois le condensateur chargé, à l’instant de date t = 0, nous le mettons en série avec
une bobine d’inductance L et de résistance r, et un conducteur ohmique de résistance R .
(Voir le document 1 en annexe)
9) Compléter le schéma de ce montage , en indiquant les flèches tension aux bornes de
la bobine et du conducteur ohmique avec la même convention que celle utilisée pour
le condensateur. Ces tensions seront notées respectivement ub et uR.
Convention récepteur les flèches représentant i et u sont en sens inverse
Voir schéma q
représentant la charge électrique de l’armature A du condensateur, donner la
relation entre q(t) et i(t) et celle qui existe entre q(t) et uC(t) . En déduire la relation
qui existe entre i(t) et uC(t).
i ( t ) = dq (t ) / dt avec i en Ampère , dq en Coulomb et dt en seconde
uc( t ) = q ( t ) / C avec uc en Volt , q ( t ) en Coulomb et C en Farad
nous obtenons q(t) = C x uC en dérivant cette expression
d/dt [q(t) ] =Cxd/dt[uc] or d/dt [q(t) ] = i ( t )
soit i ( t ) = C x duC / dt
10) Donner la relation entre ub(t) et i(t) et celle entre uR(t) et i(t).
ub ( t ) = L x di(t)/dt + r x i(t) avec ub en Volt , L en Henry et r en Ohm
uR( t ) = R x i( t ) avec uR en Volt , R en Ohm
11) En utilisant la loi d’additivité des tensions, établir que l’équation différentielle régissant
l’évolution temporelle de la tension uc aux bornes du condensateur s’écrit :
( )
0=u
LC
1
+
dt
du
Lr+R
+
dtud C
C
2C
2
La loi d’additivité des tensions s’écrit uc( t )+ uR( t ) )+ ub ( t ) = 0
En remplaçant par leur expression : uc(t) + R x i( t )+ L x di(t)/dt + r x i(t) = 0
Comme i ( t ) = C x duC / dt nous avons di(t) = C x d2 uc / dt2
de plus nous pouvons mettre i ( t ) en facteur de R+r
et diviser l’ensemble de l’équation par le produit LC
nous obtenons alors /
( )
0=u
LC
1
+
dt
du
Lr+R
+
dtud C
C
2C
2
12) Dans l’hypothèse où la résistance R+r est nulle, montrer que la fonction
uC(t) = Acos(Bt), où A et B sont des constantes, est solution de cette
équation différentielle si B a une expression qu’on déterminera.
Si r + R = 0
l’équation différentielle devient : d2uc/dt + 1/LC x uc = 0
En dérivant deux fois l’expression proposée pour uc : d2uc/dt = - AB2 cos ( Bt)
Que nous introduisons dans l’équation différentielle
- AB2 cos ( Bt) + 1/LC A cos ( Bt) = 0
mise en facteur : A cos (Bt) x [1/LC –B2] =0 Doit
être vérifiée quelque soit t
[1/LC –B2] =0
seule la valeur positive est physiquement possible
B = + 1/
LC
 6
6
 7
7
 8
8
 9
9
1
/
9
100%