On considère toutes les solutions à 25°C

DM Sciences-Physiques Terminale S6 Février 2007
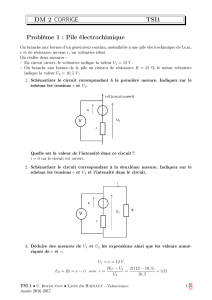
Exercice 1 : Etude d’un circuit RLC.
Partie I : étude des caractéristiques d’une bobine.
Pour déterminer les caractéristiques de la bobine
on utilise un générateur basse fréquence (GBF)
dont la masse n’est pas relié à la terre EDF.
On réalise le montage suivant où r est la résistance
interne de la bobine et L son inductance. R un
dipôle ohmique de résistance R = 8Ω. On relève
grâce à un oscilloscope les deux tensions indiquées
sur le schéma.
L’oscilloscope est reproduit ci-dessous avec les
différents réglages mentionnés.
1) Représenter UAM et UBM sur le schéma du montage expérimental
2) Exprimer UAM en fonction de i, puis UBM en fonction de r, i et L.
3) Attribuer à chaque courbe la voie de mesure de l’oscilloscope en justifiant.
4) On suppose dans cette question la bobine idéale, c'est à dire que r ≈ 0Ω.
a) Exprimer alors UBM en fonction de i et L.
b) Exprimer UBM en fonction de UAM
c) Déterminer la valeur de l’inductance de la bobine
Partie II : étude des caractéristiques du condensateur
Le condensateur est initialement déchargé. On
réalise un circuit de charge schématisé ci-contre où
R est un dipôle ohmique de résistance R = 1kΩ et
où le générateur utilisé a une fem E = 6V et une
résistance interne négligeable.
R
r
L
M
A
B
Voie B
Voie A
GBF
i
E
UC
K
i
R
q
A
B
D
Acquisition informatique
M/
A
Luminosité
Focalisatio
n
AC
0
DC
Voie A
1
2
5
10
20
50
100
20
0
500
V
mV
AC
0
DC
Voie B
1
2
5
10
20
50
100
20
0
500
V
mV
A
XY
B
-B
Dual
A
A
Synchro
ms
1
2
5
5
10
20
50
0,1
0,2
0,5
µs
V
2
Balayage
Niveau
Voie …
Voie …
Balayage : 1ms / Div
Sensibilité verticales : voie A 1V / Div
voie B 500 mV / Div

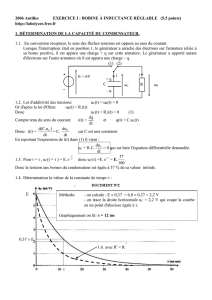
Un système d’acquisition informatique permet de relever la tension UC
1) Exprimer i en fonction de UC
2) Établir l’équation différentielle que vérifie la tension UC et montrer qu’elle est de la forme
EU
dt
dU C
C
3) Exprimer en fonction de R et C. Comment s’appelle cette constante ?
4) Déterminer la valeur de par la méthode de votre choix.
5) En déduire la valeur de la capacité C du condensateur.
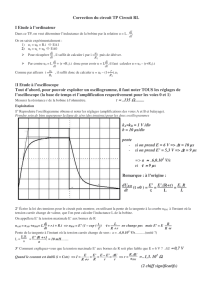
Partie III : Étude des oscillations libres du circuit RLC série
0
1
2
3
4
5
6
7
0 1 2 3 4 5 6 7
t (ms)
UC (V)
-8
-6
-4
-2
0
2
4
6
8
0 0,2 0,4 0,6 0,8 1 1,2 1,4
t (en ms)
….
Acquisition
informatique
Voie 2
E
UC
L
r
2
1
R’
Acquisition
informatique
Voie 1
i
q
La masse du circuit est
relié à la masse du
système d’acquisition

On réalise le circuit schématisé ci dessus où R’ est un potentiomètre (résistance réglable). Le
condensateur est le même que celui étudié précédemment ainsi que la bobine et le générateur (fem
6V). L’interrupteur en position 1 permet la charge du condensateur. On charge le condensateur et
on bascule l’interrupteur en position 2 à une date t0 = 0 s. Une interface permet l’acquisition
informatique de la tension UC et la tension aux bornes du potentiomètre UR’.
1) Attribuer aux deux courbes obtenues grâce à l’acquisition informatique les numéros 1 et 2
correspondant aux voies 1 et 2 de l’acquisition. Justifier.
2) Montrer, en utilisant la loi d’additivité des tensions que Uc obéit à une équation différentielle de
la forme
.
0..
2
2 C
CC U
dt
dU
dt
Ud
3) On se place dans le cas où R’ = OΩ et où la bobine est idéale. Montrer que Uc obéit à l’équation
différentielle
.
0.
1
2
2 C
CU
LC
dt
Ud
.
4) Montrer alors que Uc(t) =
0
2
.cosEt
T
est solution de l’équation différentielle avec T0
=
2LC
.
5) En fait R 0Ω. Comment peut on qualifier les oscillations du circuit RLC ainsi constitué ?
6) Déterminer grâce à l’enregistrement la pseudo-période T des oscillations. Que peut-on dire de
T par rapport à T0 ?
Partie IV : Étude énergétique des oscillations libres du circuit RLC série
On donne ci-dessous les variations des énergies emmagasinées
- par le condensateur EC (courbe A)
- par la bobine El (courbe B)
- ainsi que la somme EC + El (courbe C)
1) Rappeler l’expression des énergies emmagasinées par la bobine El et le condensateur EC à une
date t quelconque.
2) Attribuer à chaque courbe sa lettre en justifiant.
3) Que représente sur le graphique la différence ΔE représentée ? Quelle est la puissance moyenne
dissipée par effet Joule ?
-2
0
2
4
6
8
10
12
14
16
18
20
0 0,2 0,4 0,6 0,8 1 1,2 1,4
E (en J)
t (en ms)
ΔE

Exercice 2 : Influence des concentrations initiale sur la polarité d’une pile
On réalise une pile avec les couples Ag+(aq)/Ag(s) et Fe3+(aq)/Fe2+(aq).
La constante d'équilibre associée à la réaction Ag+(aq) + Fe2+(aq) = Ag(s) + Fe3+(aq) a pour
valeur K = 3,2.
1. Donner l'expression du quotient de réaction.
2. Dans la pile, les concentrations molaires initiales des ions dans les solutions aqueuses sont
[Ag+]i = [Fe2+]i = [Fe3+]i = 1,010-1 mol.L-1.
Calculer le quotient de réaction à l'état initial.
3. En déduire le sens d'évolution spontané de la réaction quand la pile fonctionne.
4. Quelle est la polarité de chaque électrode ? Justifier à partir des demi-équations.
5. On réalise une deuxième pile en modifiant les conditions initiales du système.
Les concentrations initiales sont désormais [Ag+]i = [Fe2+]i = 1,010-1 mol.L-1 et
[Fe3+]i = 1,010-2 mol.L-1.
La polarité de chaque électrode reste-t-elle la même ? Justifier.
Récepteur
pont électrolytique
électrode d'argent
électrode de platine
inattaquable
Fe2+(aq) et Fe3+(aq)
Ag+(aq)
Schéma de la pile

Exercice 3. Régulation du pH de l'eau de piscine
La régulation du pH est essentielle dans le traitement de l'eau des piscines.
En permanence analysé grâce à une sonde puis corrigé par une pompe (par injection de produit
correcteur), le pH est maintenu automatiquement à son niveau idéal (7,2 – 7,6).
Données :
On considère toutes les solutions à 25°C
Couples acide/base :
H3O+ (aq) / H2O ;
1
A
pK
= 0
H2O / HO – (aq) ;
2
A
pK
= 14
acide hypochloreux/ion hypochlorite : HClO(aq) /CIO – (aq) ;
3
A
pK
= 7,5
1. Lors d'un contrôle de pH, la sonde mesure la valeur pH = 8,5. Le pH de cette eau, plus élevé que
celui de l'humeur aqueuse de l'œil humain, est responsable de l'irritation des yeux.
1.1. À ce pH, indiquer l'espèce prédominante du couple HClO(aq)/ClO –(aq).
1.2. Calculer le rapport des concentrations en ions hypochlorite et en acide hypochloreux
lors de ce contrôle (on ne cherchera pas à déterminer ces deux concentrations).
2. Pour rétablir la valeur du pH au niveau "idéal", la pompe injecte 0,10 mol d'acide
chlorhydrique dans l'eau de la piscine, sans variation notable du volume V de l'eau contenue dans
la piscine. L'équation de la réaction associée à la transformation qui se produit est :
ClO –(aq) + H3O+(aq) = HClO(aq) + H2O (équation 1)
2.1. Exprimer la constante d'équilibre K de cette réaction en fonction de
3
A
K
. Calculer K.
2.2. L'état initial du système est défini ainsi :
- le volume de l'eau de la piscine est V = 1,0
105 L.
- on introduit 0,10 mol d'ions H3O+ par ajout d'acide chlorhydrique.
-le rapport
i
i
ClO
HClO
est égal à celui calculé au 1.2.
2.2.a. Calculer la concentration molaire effective initiale en ions H3O+ notée
[H3O+]i .
2.2.b. Calculer le quotient de réaction initial Qr,i.
2.3. En appliquant le critère d'évolution spontanée, donner le sens d'évolution de la réaction
d'équation 1.
2.4. À partir de l'expression de la constante d'acidité
3
A
K
du couple acide hypochloreux/ion
hypochlorite et du rapport
i
i
ClO
HClO
calculé au 1.2., montrer que le pH de l'eau de la piscine
diminue.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%