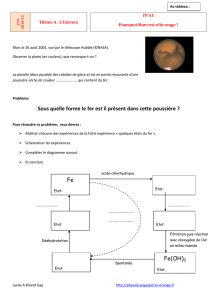
Réaction chimique

1S T.P. χ N°4.
Détermination de la composition d'un mélange constitué de deux métaux.
Le port de lunettes et de gants est obligatoire lors de la manipulation d’acide
On a mélangé du magnésium et du cuivre en copeaux. On souhaite connaître la masse de cuivre et
de magnésium ainsi mélangé.
1. Réaction de chacun des deux métaux avec l'acide chlorhydrique.
Expérience.
Réaction chimique : Dans deux tubes à essais, introduire, dans l'un, un copeau de cuivre et dans
l'autre un morceau de magnésium. Ajouter 2 mL d'acide chlorhydrique dans chaque tube.
Tests d’identification des éventuels produits formés :
Si un dégagement gazeux se produit, boucher le tube avec le pouce quelques instants puis
approcher une allumette de l'orifice du tube.
Reposer le tube et laisser réagir encore quelques minutes. Prélever un peu de solution et placer la
dans un tube à essais. Ajouter avec précautions la solution d'hydroxyde de sodium.
Observations et interprétation.
Pour chaque réactif, indiquer si une réaction a lieu avec l’acide chlorhydrique.
Si une réaction a lieu, quels sont les produits mis en évidence par les tests ? Ecrire l’équation de la
réaction.
Aide : un précipité est un solide en suspension dans un liquide. L’hydroxyde de magnésium est un
composé ionique constitué d’ions magnésium et d’ions hydroxyde dont vous pouvez déterminer la
formule.
2. Composition du mélange.
Déterminer la masse totale du mélange des deux métaux mT.
Quelle relation existe-t-il entre cette masse et la masse des deux métaux mCu et mMg ?
Réaliser le montage ci-dessous ( ! Il ne doit pas y avoir de bulle d’air dans l’éprouvette
graduée) puis suivre les indications inscrites dans le cadre.
Quelle est la valeur du volume de gaz formé Vg ? Calculer la quantité de matière de
dihydrogène formé.
Dresser le tableau d'avancement de la réaction en notant
()
i
n Mg
la quantité de matière
initiale en magnésium.
Sachant que l'acide était en excès, quelle relation lie l’avancement maximal, la quantité de
matière de dihydrogène formé et la quantité de matière initiale en magnésium ?
En déduire la quantité de matière puis la masse de métal qui a réagi.
Calculer la composition du mélange en masse et en pourcentage massique.
Introduire dans le tube à essais environ 5 mL d'acide
chlorhydrique, de concentration 1,0 mol/L
Introduire le mélange métallique et boucher
rapidement.
Mesurer le volume Vg de gaz recueilli dans
l'éprouvette graduée et observer ce qu'il reste dans
le tube à essais.
Eau

1S T.P. χ N°4.
Détermination de la composition d'un mélange constitué de deux métaux.
Le port de lunettes et de gants est obligatoire lors de la manipulation d’acide
On a mélangé du magnésium et du cuivre en copeaux. On souhaite connaître la masse de cuivre et
de magnésium ainsi mélangé.
1. Réaction de chacun des deux métaux avec l'acide chlorhydrique.
Expérience.
Réaction chimique : Dans deux tubes à essais, introduire, dans l'un, un copeau de cuivre et dans
l'autre un morceau de magnésium. Ajouter 2 mL d'acide chlorhydrique dans chaque tube.
Tests d’identification des éventuels produits formés :
Si un dégagement gazeux se produit, boucher le tube avec le pouce quelques instants puis
approcher une allumette de l'orifice du tube.
Reposer le tube et laisser réagir encore quelques minutes. Prélever un peu de solution et placer la
dans un tube à essais. Ajouter avec précautions la solution d'hydroxyde de sodium.
Observations et interprétation.
Pour chaque réactif, indiquer si une réaction a lieu avec l’acide chlorhydrique.
Si une réaction a lieu, quels sont les produits mis en évidence par les tests ? Ecrire l’équation de la
réaction.
Aide : un précipité est un solide en suspension dans un liquide. L’hydroxyde de magnésium est un
composé ionique constitué d’ions magnésium et d’ions hydroxyde dont vous pouvez déterminer la
formule.
2. Composition du mélange.
Déterminer la masse totale du mélange des deux métaux mT.
Quelle relation existe-t-il entre cette masse et la masse des deux métaux mCu et mMg ?
Réaliser le montage ci-dessous ( ! Il ne doit pas y avoir de bulle d’air dans l’éprouvette
graduée) puis suivre les indications inscrites dans le cadre.
Quelle est la valeur du volume de gaz formé Vg ? Calculer la quantité de matière de
dihydrogène formé.
Dresser le tableau d'avancement de la réaction en notant
()
i
n Mg
la quantité de matière
initiale en magnésium.
Sachant que l'acide était en excès, quelle relation lie l’avancement maximal, la quantité de
matière de dihydrogène formé et la quantité de matière initiale en magnésium ?
En déduire la quantité de matière puis la masse de métal qui a réagi.
Calculer la composition du mélange en masse et en pourcentage massique.
Introduire dans le tube à essais environ 5 mL d'acide
chlorhydrique, de concentration 1,0 mol/L
Introduire le mélange métallique et boucher
rapidement.
Mesurer le volume Vg de gaz recueilli dans
l'éprouvette graduée et observer ce qu'il reste dans
le tube à essais.
Eau
1
/
2
100%