docx

Suivi cinétique pression Page 1 sur 2
Suivi temporel d’une transformation chimique par
pressiométrie
Introduction
I) LOI DES GAZ PARFAITS
Rappeler l’équation des gaz parfaits .Préciser les unités à utiliser.
II) LA REACTION CHIMIQUE : UN EXEMPLE DE SUIVI TEMPOREL
On fait réagir le métal magnésium et l’acide chlorhydrique.
Ecrire l’équation de la réaction chimique (réactifs donnent produits)
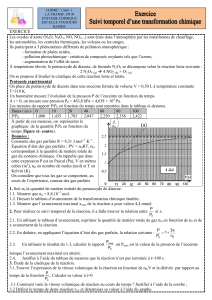
III) PROTOCOLE EXPERIMENTAL
1) Le montage (légender le montage ci-desssous)
2) Descriptif
On introduit un volume V d’acide chlorhydrique dans le flacon (voir schéma). Puis on ajoute une masse m de métal
magnésium..
La pression initiale dans le flacon est P0.
On a déclenché le chronomètre dés que le magnésium est mis en contact avec l’acide chlorhydrique.
La température θ est maintenue constante, le volume occupé par le gaz (Vgaz) est connu et demeure lui aussi
constant.
Le pressiomètre affiche la pression, laquelle sera relevée pendant 20 min environ.
IV) TABLEAU D’AVANCEMENT DE LA REACTION CHIMIQUE
équation de la réaction
Mg(s)
+
2 H+(aq)
H2(g)
+
Mg2+(aq)
état du système
avancement
Nombre de moles
état initial
0
n I (Mg)
excès
état intermédiaire
x(t)
Exprimer x(t) en fonction de n (H 2)

Suivi cinétique pression Page 2 sur 2
V) RELATION ENTRE L’AVANCEMENT ET LA PRESSION MESUREE
1) Quel est le gaz présent avant la réaction chimique ?
2) Quelle est la pression avant la réaction chimique ?
3) Quelle est la composition du gaz quand la réaction a commencé ?
Loi de Dalton : La pression exercée par un mélange de deux gaz est égale à la somme des pressions
individuelles des deux gaz.
4) En déduire la pression exercée par le gaz dihydrogène (p(H2) (t) (t) )à l’instant t
5) Exprimer p(H2) (t) en utilisant l’équation des gaz parfaits.
6) En déduire une expression de x(t) en fonction de p(H2) (t)
7) Calculer la dérivée de l’avancement x(t) .
VI) EXEMPLE
1
/
2
100%