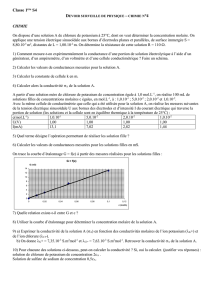
II – Conductance d`une portion de solution électrolytique.

générateur 500Hz /
1V variable
Conductance d’une solution
Objectif : Ce TP est une introduction à la conductimétrie, technique de mesure qui permet :
- d’étudier le comportement des solutions ioniques traversées par un courant alternatif,
- d’analyser ces solutions.
I – Les conditions d’étude. (voir les expériences au bureau)
1 - Pourquoi se limiter aux solutions ioniques ?
Dans un électrolyseur (ou cuve à électrolyse) on verse de l'eau
sucrée c'est à dire une solution aqueuse de saccharose C12H22O11.
On réalise la même expérience avec une solution de
chlorure de sodium.
Observer et conclure.
2 - Pourquoi travailler avec un générateur
délivrant une tension alternative ?
On remplace le générateur de tension continue par un
G.B.F.(Générateur Basses Fréquences) délivrant une tension sinusoïdale,
l'électrolyseur contient la solution de chlorure de sodium.
Observer et conclure.
II – Conductance d’une portion de solution électrolytique.
1 - Définition de la cellule conductimétrique.
La cellule conductimétrique est le dipôle constitué par :
- les deux plaques de surface S et distantes d'une longueur L.
- la portion de solution présente entre les deux plaques.
2 - Définition de la conductance.
a) Dispositif expérimental.
Dans la cuve conductimétrique, verser une solution de chlorure sodium de concentration
molaire 10-2 mol.L-1 jusqu'à la graduation 3, les électrodes (plaques) étant écartées de L = 4cm.
Réaliser le circuit schématisé ci-contre et faire vérifier le montage avant de brancher le générateur.
b) Mesures.
Faire varier la tension U aux bornes de la cellule conductimétrique, à l'aide du potentiomètre. Remplir le tableau :
U (V)
I (A)
U/I
c) Questions.
Rappeler la loi d'Ohm vue au collège pour un conducteur ohmique de résistance R.
Cette loi est-elle vérifiée pour une portion de solution électrolytique ?
On donne la définition :
Donner l'expression de la conductance G en fonction de U et I.
TP de Chimie n°4
La conductance G, en siemens (S), d'une portion de solution électrolytique, est égale à
l'inverse de la résistance R de la portion de solution électrolytique.

III – Influence des paramètres de la cellule conductimétrique.
1 - Influence des paramètres géométriques.
Mesurer la conductance d'une même solution (solution de chlorure de sodium de concentration 10-2mol.L-1) en
faisant varier les caractéristiques géométriques du système de mesure : la surface S des plaques et l'écart L entre les
plaques.
Remplir le tableau ci-dessous :
Surface des électrodes
S1
S1
S2 = 2 S1
S2 = 2 S1
Distance entre les électrodes
L1
L2 = 2L1
L1
L2 = 2L1
U (V)
I (A)
G (S)
Conclure.
2 - Influence des caractéristiques de la solution électrolytique.
Reprendre le montage de la partie II 2) : S et L doivent rester constantes.
Fixer la tension à 1 V
Réaliser les expériences nécessaires pour compléter les tableaux ci-dessous.
Vider, rincer et sécher la cuve conductimétrique entre chaque mesure
a) Influence de la concentration.
Solution
Na+(aq) + Cl-(aq)
10-2 mol.L-1
Na+(aq) + Cl-(aq)
2 x 10-3 mol.L-
Na+(aq) + Cl-(aq)
10-3 mol.L-1
U (V)
I (A)
G (S)
b) Influence de la nature de l'électrolyte.
Solution
Na+(aq) + Cl-(aq)
10-2 mol.L-1
H+(aq) + Cl-(aq)
10-2 mol.L-1
Na+(aq) + OH-(aq)
10-2 mol.L-1
U (V)
I (A)
G (S)
c) Influence de la température.
Solution
Na+(aq) + Cl-(aq)
10-2 mol.L-1
Na+(aq) + Cl-(aq)
10-2 mol.L-1
Na+(aq) + Cl-(aq)
10-2 mol.L-1
Température
Ambiante
=
Dans bain d’eau
glacée
=
Dans bain d’eau
chaude
=
U (V)
I (A)
G (S)
d) Conclusion.
1
/
2
100%