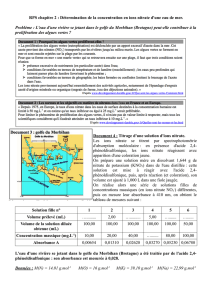
Réactions de Remplacement Simple

Réactions de Remplacement Simple
C’est où un atome d’un élément qui remplace un autre élément.
Typiquement, un composé (ionique) va réagir avec un élément.
Soit l’ion positif ou l’ion négatif peut être remplacée.
A + BX → AX + B
AX + Y → AY + X
Cu(s) + 2 AgNO3(aq) → 2 Ag(s) + Cu(NO3)2(aq)
EX: Écrivez une réaction équilibrée pour la réaction entre le zinc et l’acide
chlorhydrique.
EX: Écrivez une réaction équilibrée pour la réaction entre le chlorure d’aluminium et
le brome.
Réactions de Remplacement Double
C’est où deux composés ioniques réagissent et les ions positives des deux composés
changent de place.
En général, les composés ioniques sont dissous (s’ils sont solubles). Ces réactions
produisent souvent un précipité (un composé insoluble).
La neutralisation est un cas spécial du remplacement double où un composé est un
acide et l’autre est une base.
AX + BY → AY + BX
CuSO4(aq) + 2 NaOH(aq) → Na2SO4(aq) + Cu(OH)2(s)
EX: Écrivez une réaction équilibrée pour la réaction entre le nitrate d’aluminium et le
phosphate d’ammonium.
EX: Écrivez une réaction équilibrée pour la réaction entre l’acide sulfhydrique et
l’hydroxyde de potassium.

La Quantité (moles)
Les coefficients dans une réaction équilibrée représentent la quantité relative de
chaque substance qui réagit. On utilise une des formules suivantes:
M
m
n
si la masse d’une substance est donnée
Vcn
si le volume et la concentration molaire sont donnés
TR VP
n
si la pression, le volume et la température d’un gaz sont
données
EX: Calcule le montant de carbonate de potassium dans un échantillon de 33,5g.
EX: Calcule le montant de nitrate de zinc qui doit être dissous pour préparer 750 mL
de solution ayant une concentration de 15,8 mmol/L.
EX: Calcule le montant d’hélium dans un ballon de 8,00 L si la pression est 103 kPa
à 22,0oC.

Chimie 20 Équilibrer et Classifier les Réactions
1. Quel montant de nitrate de calcium se trouve dans un échantillon de 300 g?
2. Quel volume occupera 650 g de gaz de tétraoxyde de diazote pour exercer une
pression de 650 mm Hg à 212oC?
3. Change chacun des réactions en mots en une réaction chimique équilibrée. Classifiez
chaque réaction dans une des 5 catégories.
a. carbone + hydrogène + oxygène → acide benzoïque
b. éthanol (C2H5OH(l)) + oxygène → dioxyde de carbone + eau
c. chlorate de plomb(II) + germanium → chlorate de germanium + plomb
d. hydrogénosulfate de cobalt(III) → cobalt + hydrogène + soufre + oxygène
e. sulfate de chrome(III) + nitrate de calcium →
sulfate de calcium + nitrate de chrome (III)
4. Écrivez une réaction équilibrée pour les suivants:
a. La décomposition du dichromate de nickel(II).
b. La combustion de C6H13OH(l).
c. La formation de thiosulfate de titane(IV).
d. La réaction entre l’aluminium et le nitrate de fer(III).
e. La réaction entre le soufrure d’ammonium et le chlorate de nickel(III).
1
/
3
100%