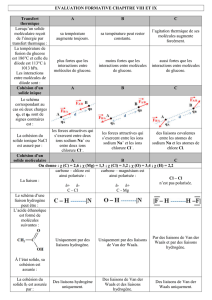
RPS chapitre 2 : Détermination de la concentration en ions nitrate d

RPS chapitre 2 : Détermination de la concentration en ions nitrate d'une eau de mer.
Problème : L'eau d'une rivière se jetant dans le golfe du Morbihan (Bretagne) peut-elle contribuer à la
prolifération des algues vertes ?
Document 4 : Titrage d'une solution d'ions nitrate.
Les ions nitrate se titrent par spectrophotométrie
d'absorption moléculaire : en présence d'acide 2,4-
phénoldisulfonique, les ions nitrate réagissent avec
apparition d'une coloration jaune.
On prépare une solution mère en dissolvant 1,644 g de
nitrate de potassium (KNO3) dans de l'eau distillée : cette
solution est mise à réagir avec l'acide 2,4-
phénoldisulfonique, puis, après réaction (et coloration), son
volume est ajusté à 1,000 L dans une fiole jaugée.
On réalise alors une série de solutions filles de
concentrations massiques (en ions nitrate NO3-) différentes,
puis on mesure leur absorbance à 410 nm, on obtient le
tableau de mesures suivant :
Solution fille n° 1 2 3 4 5 6
Volume prélevé (mL) …......... 2,00 ….......... 5,00 …....... …......
Volume de la solution diluée
obtenue (mL)
100,00 100,00 100,00 100,00 100,00 50,00
Concentration massique (mg.L-1)10,00 20,00 40,00 …....... 80,00 100,00
Absorbance A 0,00654 0,01310 0,02620 0,03270 0,05230 0,06780
L'eau d'une rivière se jetant dans le golfe du Morbihan (Bretagne) a été traitée par de l'acide 2,4-
phénoldisulfonique : son absorbance est mesurée à 0,028.
Données : M(N) = 14,01 g.mol-1 M(O) = 16 g.mol-1 M(K) = 39,10 g.mol-1 M(Na) = 22,99 g.mol-1

1. A quoi est attribuée la prolifération des algues vertes sur le littoral français ?
2. Donner les principales causes de l'augmentation de la concentration en nitrate dans l'eau des rivières.
3. Calculer la concentration molaire de la solution mère.
4. En déduire sa concentration massique en ion nitrate.
5. Calculer la concentration massique de la solution fille n°4.
6. Calculer les volumes des prélèvements nécessaires pour réaliser les solutions filles n°1, 3, 5 et 6.
7. Etablir la liste du matériel utilisé pour réaliser les solutions filles n°2 et n°6. Justifier vos réponses.
Liste du matériel mis à votre disposition :
Béchers : 50 mL 100 mL
Eprouvettes : 100 mL 50 mL 10 mL
Fioles jaugées : 50,0 mL 100 mL 25 mL
Pipettes jaugées : 1,00 mL 2,00 mL 5,00 mL 10,0 mL 20,0 mL
8. Compléter le graphe d'étalonnage (ci-dessous) :
9. Déterminer l'équation de la droite représentée ci-dessus.
10. Déterminer la concentration en ion nitrate de l'eau de la rivière se jetant dans le golfe du Morbihan
de deux façons différentes (une méthode graphique et une méthode numérique).
11. Peut-on utiliser cette rivière pour produire de l'eau potable ? Justifie ta réponse.
12. Doit-on craindre que cette rivière contribue à la prolifération des algues vertes ? Justifie ta
réponse.
1
/
2
100%