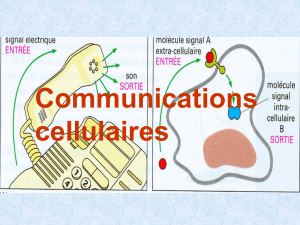
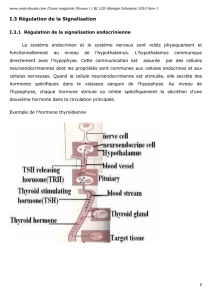
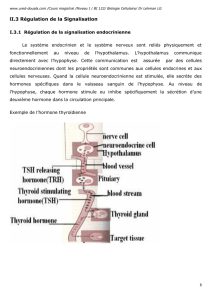
Chapitre 5 – Communication cellulaire chimique et leur régulation

1
Chapitre 5 – Communication cellulaire chimique et leur régulation
- La Cellule est capable de reconnaitre certains signaux cellulaires et de s’adapter en fonction de ces
derniers.
- Activation des cascades de signalisation intra cellulaire qui va atteindre une protéine cible :
- Enzyme du métabolisme : Altération du métabolisme.
- Protéine de régulation : Altération de l’expression génique.
- Protéine du cytosquelette : Altération des structures.
- La plupart des cellules ont besoins de signaux pour rester en vie.
- Ces signaux qui agissent vont agir sur la survie, la division ou la différenciation cellulaire.
- Lorsqu’elles n’ont plus de signaux, les cellules induisent un programme de mort cellulaire.
I – Introduction : Trois voies de communication
A) Signalisation à distance par sécrétion de médiateurs chimiques.
- Il y a 2 grands types de molécules qui vont induire des signaux.
1 - Cas des protéines hydrophiles.
- Ces molécules hydrophiles peuvent circuler librement dans le sang. Elles ne nécessitent donc pas de
transporteurs membranaires.
- Récepteur transmembranaires à la surface d’une cellule qui va reconnaître les molécules.
2 - Cas des molécules hydrophobes
- Association des molécules à des transporteurs.
- Mais comme elles sont hydrophobes, elles traversent directement la membrane.
B) Signalisation entre cellule par des molécules associées à la membrane.
- Ancrage d’une protéine membranaire qui contient une molécule de signalisation associées à la
membrane. Cette molécule se fixe à une récepteur présent sur la membrane de la cellule cible.
C) Signalisation de cellules a cellules via des jonctions communicantes.
- Echange de matériel via des canaux
- importance dans les cellules cardiaques et hépatiques.
II- Principes Généraux de la communication chimique.
A) Classification selon la distance parcourue par la molécule de signalisation
1 – Signalisation Endocrine.
- Les molécules sont en général diluées dans le sang. Les récepteurs correspondant à ces molécules
sont donc à très grande affinité. Ce qui ne sera pas le cas dans d’a
2 – Signalisation synaptique
- Signalisation à faible distance.
- On a un corps cellulaire d’un neurone qui doit faire des axones (prolongement cytoplasmique) qui
vont se mettre au contact d‘une cellule cible : Formation d’une synapse qui permet un échange de
signaux via des molécules (Neurotransmetteurs.)

2
- La communication entre Neurone est donc chimique et Electrique. Mais les Synapses en elles-même
sont bien chimiques.
- La Synapse est donc une jonction qui permet la communication entre une cellule nerveuse et une
autre cellule (Nerveuse ou pas.) Dans une Synapse chimique, le signal est formé par libération de
molécule (NT) contrairement au synapse électrique où le signal est directement électrique (Jonction
communicante qui intervienne pour ce type de transmission de signal.)
3 – Signalisation paracrine et autocrine.
- Paracrine : Une cellule émet une molécule de signal sur les autres cellules environnantes.
- Autocrine : Signal dans la même cellule ou sur des cellules de même type.
- Médiateur a action locale interviennent également pour moduler les signaux.
4 – Récepteurs sur ou dans les cellules cibles.
- Définition de Récepteur.
- Récepteur intracellulaire
B) Caractéristiques de la signalisation chimique
1 – Signalisation endocrine par sécrétion d ‘une hormone qui agit sur des cellules cibles qui portent
un récepteur spécifique de l’hormone.
- Diffusion des molécules de type Hormone dans le sang par les cellules endocrine.
- Grande affinité du récepteur pour son ligand.
2 – Signalisation synaptique par libération d’une molécule qui agit sur les cellules cibles selon le
mode synaptique ou paracrine.
- Chaque neurone, en fonction de son arborisation, contact les cellules qui l’intéressent.
- On va créer des réseaux de Neurones qui vont échanger des NT, échange très rapide.
- Ce mode de fonctionnement permet d’avoir des échelles de temps de l’ordre de la ms.
Contrairement de l’hormone où on est , en terme de temps, en minute ou en heure !
3 – Réponses différentes au même signal chimique
3.1 – Mécanisme qui présente un seul récepteur
- A l’intérieur de la cellule, on va avoir des effets différents par modulation interne.
3.2 – Mécanismes qui présnetent plusieurs récepteurs
- Cas de l’Acétylcholine.
- Ce sont les mêmes récepteurs qui vont induire des effets différents selon les tissus sur lesquels se
fixer les molécules.
4 – Réponse rapide et fugace ou réponse lente et durable.
- Si X et Y sont 2 molécules dont la concentration est de 1 000 / Cellules.
- Y : - synthétisée et dégradée : 100/secondes
- durée de vie moyenne : 10 sec.
- X : - synthétisée et dégradée : 10/secondes
- durée de vie moyenne : 100 secondes.

3
- Si j’augmente X et Y d’un facteur 10, Le changement de leur durée de vie, Au bout d’une seconde :
- Y aura augmenté sa concentration de 900 molécules.
- X aura augmenté sa concentration de de 90 molécules.
- Voir les graphiques sur le cours.
6 – Destruction récupération et immobilisation des médiateurs à action locale.
7 - Plusieurs sortes de molécules signalisation Hydrophobes
7.1 – Molécules hydrophobes
- Beaucoup dérivent du Cholestérol.
- Régule l’expression des gènes.
- Acide rétinoïque : Molécule de signalisation qui est importante pour la mise en place des organes au
cours du développement.
7.2 - Molécules gazeuses
- Le Monoxyde d’Azote agit sur la Dilatation des vaisseaux (Action sur les tissus musculaires lisses qui
entourent les vaisseaux sanguins.)
- GMP Cyclique : le Phosphate est lié 3’ et 5’ du Ribose.
- Explication de l’action du NO dans la dilatation des VS.
- Angine de Poitrine : Activation du NO et donc relaxation des muscles.
On prescrit du Trinitrine.
- Viagra : Inhibiteur de la Phospho-Diesterase.
8 – Deux types de récepteurs
8.1 – A Activité intranucléaire.
- Grande famille des Stéroïdes ont ce type d’activité.
- Le Cortisol.
- La Testostérone.
- Thyroxine.
- Oestradiol.
- Vitamine D.
- Les Récepteurs à activité nucléaire ont des protéines qui ont des sites de liaisons à l’ADN.
- Les Facteur de Transcription ont une structure modulaire. Ils possèdent des domaines !
- De liaison à l’ADN
- De régulation de la transcription
- De liaison au ligand.
- La plupart des récepteurs connus ont le même domaine de la liaison à l’ADN (qui est une séquence
de – de 10 nucléotides.)
- Lorsque le ligand est absent, ce récepteur inactive l’expression du gène. Lorsque le ligand arrive, il
va activer l’expression du gène.
- Ces récepteurs nucléaires sont donc modulés de « répresseurs » à « activateurs » par cette liaison
du ligand.
- On a réussi à déterminer la structure d’un récepteur nucléaire par Cristallographie (Laboratoire de
Strasbourg.)

4
- Il y a 2 types de réponses :
-Réponse primaire : L’Hormone se fixe, le récepteur devient activateur, les gènes produisent
des ARNm produit en protéine la synthèse d’ARNm ne dépend pas des protéines produites.
-Réponse Secondaire : Parmi les gènes activés par le récepteur, certains gènes vont réguler
d’autres gènes. C’est une réponse retardée par rapport à la première réponse.
8.2 – Porté par la membrane plasmique
- Fixe des molécules hydrophiles incapables de rentrer dans le Cytosol.
- Trois sortes :
- Canaux ioniques : Ouverture du canal lorsque fixation de la molécule.
Exemple de l’Acétyl Choline qui en se fixant permettent le passage de Sodium dans le Cytosol.
(Type Nicotinique).
- Les Récepteurs couplés aux protéines G. Ces récepteurs fonctionnent avec une cascade de
réactions. Un récepteur, fixé dans la membrane, va voir une molécule se fixer dessus. La Protéine G
associée va lier le GTP. Ces protéines G sont liées aux membranes par la liaison covalentes de lipides.
Ces protéines G vont transmettre le message en agissant soit sur une enzyme (Adénylyl Cyclase) soit
sur des canaux ioniques. C’est la plus grande famille de récepteurs qui permettent beaucoup de
phénomène (Olfaction.)
Récepteurs muscariniques sont des récepteurs couplés à la protéine G.
- Les récepteurs couplés à une activité enzymatique (Récepteurs des Kinases) qui
fonctionnent tous de la même façon (forme de dimère.) Réunification d’un dimère puis activation
d’un domaine catalytique. Fonctionnement par des Hétéro-dimère ou Homo-dimère (MAIS le
résultat sera identique.)
9 – Activité des récepteurs relayés par des petites molécules.
- Si un réseau de protéines de signalisation intracellulaire.
Permet de percevoir un message, (Il suffit de 10 photons pour que le cerveau reçoive un message)
ou de le réguler (si trop de Photon.)
- Transduction primaire :
- Relais
- Transduction et Amplification
- Intégration
- Dissémination.
- Arrimage : Accrochage de protéine sur des parois cellulaires ou d’organites.
- Modulation
- Activation de la protéine effectrice.

5
- Il existe différentes sortes de molécules et de protéines de signalisation intracellulaire qui
englobent la cascade de signalisation.
- Protéines relais
- Messager : Petites molécules produites (Calcium ou AMPc)
- Adaptateurs
- Amplificateurs
- Aiguillage
- Transducteurs
- Intégrateurs.
10 – Rôle d’interrupteur joué par certaines protéines des signalisation.
- Les protéines interruptrices sont de 2 grands types.
10. 1 - Signalisation par phosphorylation
- Sérine/Thréonine Kinase (+++)
- Tyrosine Kinase
- 2 % de nos gènes sont des gènes codants pour des Enzymes de type « Kinases ».
10.2 – Signalisation par fixation au GTP.
- Activation par GEF et hydrolyse du GTP par GAP.
11 – Intégration intracellulaire de la signalisation.
- Deux signaux qui peuvent converger vers une même protéine.
- Cette protéine ne peut être active que si les deux signaux convergent (2 Phosphorylation par
exemple)
12 – Mise en place de complexe de signalisation intracellulaire pour augmenter la spécificité la
réponse de la réponse.
- Protéine échafaudage qui va recruter plusieurs autres protéines par activation de l’une d’entre elle.
La cascade de Phosphorylation est donc d’autant plus rapide ainsi.
- Quand un récepteur s’active, il va créer un environnement spécifique qui va attirer des protéines
libres dans le cytoplasme qui vont s’accrocher à ce récepteur.
13 – Interactions entre protéines de signalisation par l’intermédiaire de domaines de liaisons sous
forme de module.
- Formation d’un gros (Terreuuuuuuuuuuux) complexe.
14 – Réponse abrupte de la cellule a une augmentation progressive de la molécule de signalisation
extracellulaire.
- Evolution Sigmoïdale pour une réponse abrupte comparée à une réponse progressive de type
exponentielle.
- Quand on observe une réponse, on observe une population cellulaire. Dès lors une évolution
identique pour 2 expériences ne veut pas dire que le mécanisme est le même. Une évolution
progressive peut être due à une évolution progressive des cellules de manière cohérente ou à une
évolution abrupte de chaque cellule mais l’une après l’autre.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%