Mobilisation des triglycérides du tissus adipeux

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume VI, n° 2, mars-avril 2002
Les triglycérides du tissu adipeux constituent
la réserve énergétique la plus importante de
l’organisme. En situation de déficit énergé-
tique, leur mobilisation joue un rôle essentiel
dans l’approvisionnement en acides gras non
estérifiés au myocarde, au muscle squelettique,
au rein et au foie. L’utilisation des acides gras
permet l’épargne du glucose, dont les réserves
sont beaucoup plus limitées. Une altération de
la capacité lipolytique du tissu adipeux pour-
rait être un élément qui prédispose à l’obésité.
Lors de restrictions caloriques, l’importance
de la perte de poids pourrait être associée à la
capacité lipolytique du tissu adipeux. À l’op-
posé, des concentrations élevées d’acides gras
libres résultant d’une masse de tissu adipeux
importante et d’un défaut d’utilisation par le
muscle et le foie peuvent contribuer au déve-
loppement des complications métaboliques
associées à l’obésité, comme le syndrome d’in-
sulinorésistance, en particulier chez les sujets
présentant une obésité abdominale.
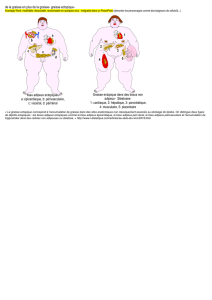
La figurereprésente un schéma simplifié de la
cascade lipolytique dans le tissu adipeux. L’ac-
cent a été mis sur les découvertes récentes.
Toutes les voies de transduction ne sont pas
représentées. Pour une description exhaustive
des données de la littérature, le lecteur pourra
se référer à des revues récentes (1, 2). Plusieurs
lipases sont impliquées dans l’hydrolyse des
triglycérides. La lipase hormono-sensible
(LHS) participe in vivo à l’hydrolyse des tri-
glycérides et des diglycérides. L’activité de la
lipase des monoglycérides ne semble pas
modulée par les hormones. Les catécholamines
(adrénaline et noradrénaline) et l’insuline sont
les régulateurs de la cascade lipolytique les
plus étudiés. Le point de jonction des voies de
transduction est l’AMP cyclique (AMPc).
D’autres systèmes de contrôle de la lipolyse
ont été caractérisés. Leur importance physio-
logique n’est qu’imparfaitement connue.
50
Dossier : obésité
Mobilisation des triglycérides
du tissu adipeux
D. Langin*
La lipolyse du tissu adipeux est le processus catabolique qui conduit de l’hydrolyse
des triglycérides à la libération dans le courant sanguin d’acides gras libres
et de glycérol. Les travaux de recherche récents ont permis de mieux appréhender
les rôles respectifs des récepteurs lipolytiques ß-adrénergiques et antilipolytiques
α2-adrénergiques des catécholamines. Plusieurs nouvelles voies de transduction ont
été caractérisées. En particulier, un effet lipolytique puissant des peptides
natriurétiques a été démontré in vivo et in vitro chez l’homme. Les mécanismes
moléculaires de l’hydrolyse des triglycérides s’avèrent complexes. Plusieurs pro-
téines sont impliquées, dont la lipase hormono-sensible, une protéine
de transport des acides gras et des périlipines, protéines qui contrôlent l’accès à la
gouttelette lipidique. Les relations entre le niveau d’expression de la lipase
hormono-sensible et la capacité lipolytique du tissu adipeux ont été étudiées dans
plusieurs situations physiologiques et pathologiques chez l’homme.
Figure . Schéma de l’activation de la lipolyse adipocytaire.
AC : adényl cyclase ; AG : acide gras ; ALBP : adipocyte lipid binding protein ; GC : guanylyl cyclase ; Gi : pro-
téine G inhibitrice ; Gs : protéine G stimulante ; JNK : c-Jun-NH2-terminal kinase ; LHS : lipase hormonosen-
sible ; IRS : insulin receptor substrate ; p42/p44 : p42/44 mitogen-activated protein kinases ; PDE-3B : phos-
phodiestérase 3B ; PI3-K : phosphatidyl-inositol-3-phosphate kinase ; PKA : protéine kinase A ; PKB : protéine
kinase B ; PKG : protéine kinase G.
* INSERM, unité 317, institut Louis-Bugnard,
CHU de Rangueil, université Paul-Sabatier,
Toulouse.

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume VI, n° 2, mars-avril 2002
Modulation de la lipolyse
adipocytaire par
les catécholamines
Les catécholamines agissent par deux types de
récepteurs. Chez l’homme, les effets stimulants
sont relayés par les récepteurs ß1- et ß2-
adrénergiques. Le rôle du récepteur ß3-adr-
énergique semble négligeable dans le tissu adi-
peux sous-cutané. Le récepteur α2-adrénergique
relaie l’effet inhibiteur des catécholamines. La
lipolyse adrénergique est donc la résultante de
la balance fonctionnelle entre récepteurs acti-
vateurs et récepteurs inhibiteurs. De nom-
breuses études in vitro ont montré que l’équi-
pement en récepteurs α2- et ß-adrénergiques
varie selon la localisation anatomique du tissu
adipeux, le sexe et l’âge des sujets. Les modi-
fications physiologiques et pathologiques de la
réponse lipolytique aux catécholamines dans
les adipocytes humains sont récapitulées dans
le tableau.Récemment, une série d’études a
porté sur les modifications de l’équilibre entre
les voies α2- et ß-adrénergiques et leur signi-
fication physiopathologique (3, 4). Ces travaux
révèlent que l’activation physiologique des
récepteurs α2-adrénergiques durant l’exercice
physique contribue fortement à l’altération de
la réponse lipolytique aux catécholamines dans
le tissu adipeux des patients obèses. Ces résul-
tats, qui doivent être confirmés dans d’autres
situations physiopathologiques, suggèrent
qu’une diminution de la réponse ß-adréner-
gique démasque la réponse antilipolytique α2-
adrénergique et peut conduire à une capacité
lipolytique altérée. La démonstration d’un rôle
des récepteurs α2-adrénergiques peut avoir des
implications chez les hommes développant de
larges quantités de tissu adipeux sous-cutané
ou chez les femmes ayant des dépôts adipeux
fémoraux importants. La diminution de la
capacité lipolytique des adipocytes hypertro-
phiés, due à une plus forte expression des
récepteurs α2-adrénergiques, pourrait consti-
tuer une adaptation visant à limiter l’excès de
libération d’acides gras dans le courant san-
guin. Par ailleurs, on peut émettre l’hypothèse
que les récepteurs α2-adrénergiques jouent un
rôle dans la résistance à la diminution de la
masse de tissu adipeux sous-cutané lors de
régimes hypocaloriques et de programmes
d’exercice physique.
Les peptides natriurétiques
Contrairement à ce qu’il advient chez les ron-
geurs, les peptides lipolytiques (ACTH,
51
Dossier : obésité
Tableau . Variations de la réponse lipolytique aux catécholamines dans le tissu adipeux humain.
Situations physiologiques Réponse Niveau de modulation
et pathologiques lipolytique
Période néonatale Diminution Réponse α2-adrénergique ↑
Vieillissement Diminution Activation de la LHS ↓
Différences selon le sexe Variable Modification des effets α2-
et ß-adrénergiques
Expression de la LHS corrélée
positivement à la taille cellulaire
Différences territoriales Variable idem
Régime à basses calories Augmentation Expression de la LHS ↑
Exercice Augmentation Réponse ß-adrénergique ↑
Obésité Diminuée Expression de la LHS
et du récepteur ß2-adrénergique ↓
Syndrome de résistance Diminuée Activation de la LHS et nombre
à l’insuline de récepteurs ß2-adrénergiques ↓
Résistance Diminuée Réponse et nombre de récepteurs
aux catécholamines ß2-adrénergiques ↓
Hyperlipidémie familiale Diminuée Expression de la LHS ↓
combinée
Syndrome des ovaires Diminuée Activation de la LHS et nombre de
polykystiques récepteurs ß2-adrénergiques ↓
Hypothyroïdisme Diminuée Activation de la LHS ↓
Hyperthyroïdisme Augmentée Nombre des récepteurs
ß2-adrénergiques ↑
Syndrome de Cushing Diminuée Inconnu
Phéochromocytome Diminuée Inconnu
Diabète de type I Augmentée Réponse ß-adrénergique ↑
Microgravité Augmentée Réponse ß-adrénergique ↓
Infusion d’adrénaline Diminuée Réponse ß-adrénergique ↓

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume VI, n° 2, mars-avril 2002
αMSH, glucagon) sont peu actifs chez
l’homme. À la recherche d’une nouvelle voie
d’activation de la lipolyse, un effet potentiel
du peptide natriurétique atrial (ANP) a été étu-
dié (5). Le peptide exerce un effet lipolytique
puissant, qui est équivalent à celui de l’isopré-
naline, un agoniste ß-adrénergique. L’ANP, le
BNP (brain natriuretic peptide) et le CNP (C-
type natriuretic peptide) stimulent la lipolyse
avec un ordre de potentialité (ANP > BNP >
CNP) qui suggère l’implication d’un récepteur
aux peptides natriurétiques de type A. L’acti-
vation du récepteur est associée à une aug-
mentation des taux intracellulaires de GMPc.
La phosphodiestérase 3B (PDE-3B) et l’adé-
nyl-cyclase ne sont pas impliquées dans la voie
de transduction. En revanche, la LHS est phos-
phorylée en réponse à l’ANP. Ces données
montrent que l’ANP stimule la lipolyse par une
nouvelle voie de transduction qui n’implique
pas une modulation des taux d’AMPc. La
microdialyse in situ permet de révéler que l’ef-
fet lipolytique de l’ANP est également puis-
sant in vivo chez l’homme.
L’hormone de croissance
L’hormone de croissance stimule la lipolyse
dans les adipocytes humains. Son mécanisme
d’action n’est pas totalement clarifié. L’aug-
mentation physiologique des concentrations
plasmatiques d’hormone de croissance durant
la nuit s’accompagne d’une augmentation de
la lipolyse (6). D’ailleurs, lorsqu’une infusion
pulsatile de l’hormone est réalisée, la produc-
tion de glycérol par le tissu adipeux est aug-
mentée (7). Il semble que l’hormone de crois-
sance exerce un effet lipolytique préférentiel
sur les dépôts adipeux intra-abdominaux.
Le facteur de nécrose tumorale
TNFα
Le TNFαest produit par les macrophages,
mais également par les adipocytes. La pro-
duction adipocytaire a probablement un rôle
local dans le tissu adipeux et non systémique
chez l’homme. Le TNFαest un puissant agent
lipolytique, mais son action est lente. Le méca-
nisme exact est en cours de décryptage. Les
expériences les plus récentes suggèrent que le
TNFαagit essentiellement par l’intermédiaire
du récepteur de type 1. Cette activation entraîne
une stimulation de la voie des mitogen-activa-
ted protein kinases de type p42/p44 et c-Jun-
NH2-terminal kinase et conduit par des étapes
non élucidées à une diminution de l’expression
des protéines G inhibitrices et des périlipines
(8-10). L’augmentation de la lipolyse résulte-
rait donc d’une levée de tonus inhibiteur et
d’une facilitation de l’accès des lipases à la
gouttelette lipidique.
Effet antilipolytique de l’insuline
L’insuline et les facteurs de croissance se lient
à des récepteurs à activité tyrosine kinase. L’ac-
tivation de ces récepteurs entraîne une auto-
phosphorylation et la phosphorylation des sub-
strats du récepteur de l’insuline 1 et 2. Cette
étape est suivie d’une activation de la phos-
phatidyl-inositol-3 kinase, de la protéine kinase
B et finalement de la PDE-3B. Cette enzyme
hydrolyse l’AMPc en 5’AMP ce qui conduit à
une diminution de la lipolyse.
Autres systèmes inhibiteurs
de la lipolyse
Comme le récepteur α2-adrénergique des caté-
cholamines, plusieurs récepteurs sont couplés
aux protéines G inhibitrices dans l’adipocyte
humain. Ces récepteurs sont activés par des neu-
ropeptides comme le NPY ou le PYY ou des
facteurs paracrines (adénosine, prostaglandines
et leurs métabolites). L’effet antilipolytique du
NPY, relayé par un récepteur de type 1, est
important dans les adipocytes humains. Les fac-
teurs paracrines sont produits par les adipocytes
eux-mêmes, les préadipocytes ou les cellules
endothéliales. Le métabolisme de ces facteurs
est très rapide, ce qui complique leur étude in vivo.
Complexité inattendue
de l’hydrolyse des triglycérides
L’hydrolyse des triglycérides par les lipases du
tissu adipeux est un processus complexe fai-
sant intervenir des mécanismes qui ne sont pas
totalement élucidés et de nouveaux partenaires
dont les rôles restent à définir (11,12).La phos-
phorylation de résidus de sérines par la pro-
téine kinase A entraîne l’activation de la LHS.
La comparaison des résultats obtenus in vitro
et in vivo implique qu’un simple changement
de conformation de la LHS phosphorylée n’ex-
plique pas totalement la stimulation de la lipo-
lyse. Il a cependant été suggéré, par compa-
raison avec d’autres lipases de triglycérides,
que la LHS existe en deux états de conforma-
tion, un état ouvert, dans lequel le site cataly-
tique est démasqué et où une surface hydro-
phobe de contact avec les lipides est exposée,
et un état fermé, inactif. La phosphorylation
permettrait la transition de la forme fermée à
la forme active. In vivo, la translocation de la
LHS d’un compartiment cytosolique vers la
surface de la gouttelette lipidique semble être
une étape cruciale de l’activation lipolytique.
Ce processus d’activation fait vraisemblable-
ment intervenir d’autres protéines qui ne sont
pas directement impliquées dans le processus
catalytique. Les périlipines sont des protéines
très abondantes dans l’adipocyte mature. Elles
couvrent les grosses gouttelettes lipidiques et
empêchent l’hydrolyse des lipides en bloquant
l’accès des lipases à leurs substrats. Durant la
lipolyse, la phosphorylation des périlipines
entraînerait un remodelage de la surface de la
gouttelette qui permettrait l’accès de la LHS.
Les souris déficientes en périlipines sont
maigres, ce qui souligne le rôle crucial de l’ef-
fet protecteur vis-à-vis de la LHS de ces pro-
téines (13). Il a été montré très récemment que
deux protéines interagissent directement avec
la LHS : la protéine de transport des acides gras
ALBP (adipocyte lipid binding protein) ou aP2
et la lipotransine. La liaison de l’ALBP à la
partie N-terminale de la LHS permet d’éviter
une accumulation locale d’acides gras issus de
la lipolyse et de favoriser leur exportation vers
l’extérieur de la cellule. L’observation d’une
52
Dossier : obésité

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume VI, n° 2, mars-avril 2002
lipolyse diminuée chez les souris déficientes
en ALBP est en accord avec ce “scénario”. La
lipotransine est également une protéine d’an-
crage de la LHS ; cependant son rôle exact reste
à déterminer.
La vue classique d’activation de la lipolyse,
résultant de 30 années de recherche dans le
domaine, postule que la LHS catalyse l’étape
limitante de la lipolyse adipocytaire. Les don-
nées récentes obtenues sur les souris dont le
gène de la LHS a été inactivé conduisent à une
réappréciation du rôle de l’enzyme dans cette
voie catabolique. Les souris sans LHS ne sont
pas obèses. Dans le tissu adipeux blanc, la lipo-
lyse induite par les catécholamines est forte-
ment diminuée, mais la lipolyse basale (en
l’absence d’agonistes) est inchangée. Une
accumulation de diglycérides est observée dans
le tissu adipeux, ce qui montre que l’activité
de lipase des diglycérides est bien assurée par
la LHS. Ces données suggèrent donc l’exis-
tence d’une autre lipase de triglycérides dans
le tissu adipeux des souris déficientes en LHS.
La nature de cette lipase n’est pas connue. Un
point essentiel qui découle de ce travail est la
contribution de cette lipase dans le tissu adi-
peux de souris sauvages et dans le tissu adi-
peux humain. En d’autres termes, il convien-
dra de déterminer si l’expression de cette lipase
dans le tissu adipeux n’est pas secondaire à
l’invalidation du gène de la LHS. Les préadi-
pocytes possèdent une faible activité lipase
neutre, dont la nature est inconnue. Il est pos-
sible que cette lipase remplace la LHS chez les
souris déficientes en cette enzyme.
Régulation de l’expression
de la LHS et lipolyse adipocytaire
Durant ces dernières années, plusieurs études
cliniques ont été entreprises pour explorer les
relations entre la LHS et la lipolyse (2). Les
mécanismes moléculaires de régulation de la
lipolyse adipocytaire ont été étudiés pendant
ou après, une restriction calorique contrôlée
utilisant les régimes à basses calories (very
low-calorie diet, VLCD). Il convient de bien
distinguer les adaptations métaboliques se pro-
duisant lors de la phase dynamique de restric-
tion calorique, de celles mises en jeu lors de la
phase de stabilisation à un nouveau poids par
un régime isocalorique. Pendant la période de
restriction calorique, la lipolyse de base des
cellules adipeuses est doublée. L’étude sur des
jumelles monozygotes obèses a révélé que
l’augmentation de la lipolyse de base possède
une composante génétique. Cette augmenta-
tion pourrait être expliquée par le doublement
de l’activité enzymatique et de la quantité de
protéine LHS. Durant la restriction calorique,
l’augmentation de la capacité lipolytique pour-
rait constituer une adaptation métabolique
visant à fournir en quantités suffisantes des
substrats énergétiques, sous forme d’acides
gras, aux différents tissus. L’effet de la réduc-
tion de poids sur la lipolyse a également été
étudié, cinq semaines après arrêt du régime,
sur des femmes présentant une obésité
androïde. Dans ce cas, la lipolyse de base des
adipocytes est diminuée de moitié, ainsi que
l’activité enzymatique de la LHS. Il reste à étu-
dier si cette baisse de capacité lipolytique peut
contribuer au regain de poids souvent constaté
après des programmes d’amaigrissement.
Une altération de l’expression de la LHS asso-
ciée à une baisse de la capacité lipolytique des
adipocytes pourrait constituer une perturbation
précoce du métabolisme chez les sujets ayant une
tendance familiale à l’obésité. De plus, une
récente étude portant sur des sujets de corpulence
variable a révélé qu’une faible capacité lipoly-
tique due à une faible expression de la LHS était
associée à l’obésité. Une autre maladie à risque
cardiovasculaire élevé, l’hyperlipidémie familiale
combinée, s’accompagne d’une diminution de la
capacité lipolytique et de l’expression de la LHS.
Conclusion
Les récents travaux sur la lipolyse adipocytaire
montrent que cette voie catabolique n’est
encore que très imparfaitement comprise. Sont
à préciser les contributions respectives des dif-
férents éléments du complexe lipasique (LHS,
ALBP, lipotransine, lipase des monoglycé-
rides) au mécanisme d’activation de la lipo-
lyse. C’est aussi, par ailleurs, une autre ques-
tion à résoudre que celle de la présence et du
rôle éventuel d’une autre lipase de triglycérides
dans le tissu adipeux humain. Les réponses à
ces questions sont un préalable pour réévaluer
les mécanismes qui sous-tendent les altérations
de la lipolyse (tableau).La découverte de l’effet
lipolytique de l’ANP et l’appréciation du rôle
in vivo du récepteur α2-adrénergique ouvrent
de nouvelles perspectives pharmacologiques
dans le contrôle de la lipomobilisation.
Références
1. Lafontan M, Langin D. Régulation neuro-
humorale de la lipolyse : aspects physiologiques
et pathologiques. Médecine-Sciences 1998 ; 8-9 :
865-76.
2. Langin D, Lucas S, Lafontan M. Millenium fat
cell lipolysis reveals unsuspected novel tracks.
Horm Metab Res 2000 ; 32 : 443-52.
3. Stich V, de Glisezinski I, Suljkovicova H et al.
Activation of antilipolytic
α
2-adrenergic receptors
by epinephrine during exercise in human adipose
tissue. Am J Physiol 1999 ; 277 : R1076-83.
4. Stich V, de Glisezinski I, Crampes F et al.
Activation of
α
2-adrenergic receptors impairs
exercise-induced lipolysis in SCAT of obese sub-
jects. Am J Physiol 2000 ; 279 : R499-504.
5. Sengenes C, Berlan M, de Glisezinski I et al.
Natriuretic peptides : a new lipolytic pathway in
human adipocytes. FASEB J 2000 ; 14 : 1345-51.
6. Samra JS, Clark ML, Humphreys SM et al.
Suppression of the nocturnal rise in growth hor-
mone reduces subsequent lipolysis in subcuta-
neous adipose tissue. Eur J Clin Invest 1999 ; 29 :
1045-52.
7. Gravholt CH, Schmitz O, Simonsen L et al.
Effects of a physiological GH pulse on interstitial
glycerol in abdominal and femoral adipose tissue.
Am J Physiol 1999 ; 277 : E848-54.
8. Souza SC, Vargas LMD, Yamamoto MT et al.
Overexpression of perilipin A and B blocks the
ability of tumor necrosis factor-
α
to increase lipo-
lysis in 3T3-L1 adipocytes. J Biol Chem 1998 ;
273 : 24665-9.
9. Gasic S, Tian B, Green A. Tumor necrosis fac-
tor alpha stimulates lipolysis in adipocytes by
decreasing Gi protein concentrations. J Biol
Chem 1999 ; 274 : 6770-5.
10. Rydén M, Dicker A, van Harmelen V et al.
Mapping of early signaling events in tumor necro-
sis factor-alpha-mediated lipolysis in human fat
cells. J Biol Chem 2002 ; 277 : 1085-91.
11. Langin D, Holm C, Lafontan M. Adipocyte
hormone-sensitive lipase : a major regulator of
lipid metabolism. Proc Nutr Soc 1996 ; 55 : 93-
109.
12. Holm C, Osterlund T, Laurell H, Contreras JA.
Molecular mechanisms regulating hormone-sensi-
tive lipase and lipolysis. Ann Rev Nutr 2000 ; 20 :
365-93.
13. Martinez-Botas J, Anderson JB, Tessier D et
al. Absence of perilipin results in leanness and
reverses obesity in Leprdb/db mice. Nat Genet
2000 ; 26 : 474-9.
53
Dossier : obésité
1
/
4
100%