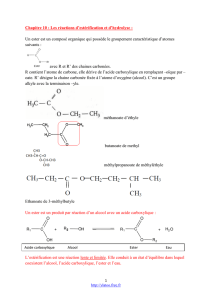
Un acide carboxylique et un alcool réagissent pour donner un ester

Nom : ……………………………….. Prénom : ……………………………………….. Classe : ………………………….
1
Activité
①
OBJECTIFS
D’écrire la réaction d’estérification et la réaction d’hydrolyse.
De connaître les caractéristiques de ces réactions.
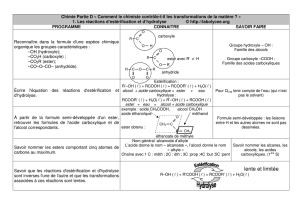
1- La réaction d’estérification et d’hydrolyse
Un acide carboxylique et un alcool réagissent pour donner un ester et de
l’eau. C’est la réaction d’estérification.
Inversement l’ester en présence d’eau s’hydrolyse.
Application : Ecrire la réaction d’estérification entre l’acide propanoïque et l’éthanol.
3- Caractéristiques de cette réaction
En fonction du temps il se forme un équilibre entre les différentes espèces
chimiques.
La réaction d’estérification n’est pas totale, c’est une réaction limitée.
En portant d’une mole d’acide et d’une mole d’alcool on obtient au mieux 0,66
mole d’ester (2/3) et 0,66 mole d’eau (2/3). Cette réaction est lente.
A température ambiante, la composition du mélange évolue durant une
centaine d’heures.

Nom : ……………………………….. Prénom : ……………………………………….. Classe : ………………………….
2
L’hydrolyse est une réaction limitée. En partant d’une mole d’ester et d’une mole d’eau on obtient au
plus 0,33 mole d’acide (1/3) et 0,33 mole d’alcool (1/3).
L’état final obtenu est le même que l’on parte d’un mélange équimolaire d’acide carboxylique et
d’alcool ou d’ester et d’eau.
Dans cet état final les proportions des différents constituants du mélange
n’évolue pas au cours du temps. Il s’agit d’un état d’équilibre que l’on traduit
par l’équation :
Acide + alcool ester + eau
4- Evolution de cet équilibre
4-1 Influence de la température
Il est possible de contrôler la vitesse de l’équilibre en modifiant la
température du mélange réactionnel.
A température élevée l’équilibre est atteint plus rapidement sans modifier les
proportions.
4-2 La catalyse
Un catalyseur est un corps qui augmente la vitesse d’évolution d’une
transformation sans apparaître dans le bilan de la réaction.
4-3 Déplacement de l’équilibre (Loi relative aux concentrations)
Nombre de moles d’acide
Nombre de moles d’alcool
Nombre de moles d’ester formé
1
1
0,66
1
5
0,95
5
1
0,95
Conclusion : La quantité d’ester augmente sensiblement lorsque l’on augmente
la quantité de l’un des réactifs. On modifie alors les proportions de l’équilibre
donc le rendement de la réaction.
Equilibre final

Nom : ……………………………….. Prénom : ……………………………………….. Classe : ………………………….
3
Activité
②
OBJECTIFS
Ecrire une réaction de saponification.
1- La saponification
La réaction de saponification est une réaction
d’hydrolyse d’un ester par remplacement de l’eau par
une base forte. Le sel obtenu constitue un savon. Cette
réaction est totale.
Exemple : Ecrire la réaction de saponification du butanoate d’éthyle avec une base.
2- Saponification d’un triglycéride
La saponification d’un triglycéride (ester du glycérol) en présence d’une base, conduit a la formation
d’un savon. Voici un exemple de réaction :
1
/
3
100%