article original Caractérisation clinico

article original
Caractérisation clinico-épidémiologique
des infections à Acinetobacter baumannii résistant
à l’imipénème au CHU Sahloul, Tunisie
Clinical and epidemiological characterization of infections
due to imipenem resistant Acinetobacter baumannii
at the university hospital Sahloul, Tunisia
W. Mansour
1
O. Bouallegue
1
S. Jeday
1
W. Naïja
2
N. Boujaafar
1
1
Unité des infections à bactéries
multirésistantes aux antibiotiques,
UR/29/04, Laboratoire de microbiologie,
2
Service de réanimation,
CHU Sahloul, 4054 Sousse, Tunisie
Article reçu le 29 mars 2007,
accepté le 8 août 2007
Résumé.Objectif :
caractériser les infections à Acinetobacter baumannii et les
différents facteurs incriminés dans son acquisition au CHU Sahloul en Tunisie.
Matériel et méthodes : étude rétrospective incluant vingt-quatre Acinetobacter
baumannii isolés à partir de vingt patients dans différents services de l’hôpital.
Étude des dossiers cliniques, identification des bactéries par les techniques conven-
tionnelles, étude de la sensibilité aux antibiotiques par réalisation des antibiogram-
mes par la méthode de diffusion en milieu gélosé, typage génotypique par PCR
utilisant une amorce arbitraire. Résultats : les bactéries sélectionnées étaient isolées
essentiellement du service de réanimation à partir d’hémocultures. Toutes les sou-
ches étaient multirésistantes et ont montré une clonalité parfaite par le génotypage.
Les principaux paramètres liés à l’infection par ces germes multirésistants étaient
l’immunodépression, les manœuvres invasives et l’antibiothérapie de large spectre.
Conclusion : l’infection par Acinetobacter baumannii multirésistants est en crois-
sance perpétuelle au niveau de notre hôpital ; une meilleure gestion des antibiothé-
rapies appliquées et l’application plus draconienne des règles d’hygiène permet-
traient de limiter la dissémination de tels germes.
Mots clés :Acinetobacter baumannii, multirésistance, génotypage, infection,
antibiotique
Abstract.Objective:
to characterize epidemiological and clinical features related
to the multi-drug Acinetobacter baumannii infections in the university hospital
Sahloul in Tunisia. Material and methods: retrospective study including twenty-
four imipenem resistant Acinetobacter baumannii isolated from twenty patients
hospitalized in different wards of the hospital. Study of clinical features related to
the infection by multi-drug Acinetobacter baumannii, bacterial identification by
classical identification sheme, antibiotic susceptibilities were determined by the
disk diffusion method; genotyping was performed by arbitrarily-primed PCR.
Results: the most incriminated ward was the intensive care unit with a high preva-
lence of septicaemia. All studied strains were multi-drug to all b-lactams tested.
Genotyping has shown the clonality of studied strains. Features incriminated in the
acquisition of infection were essentially immunodeficiency, invasive manoeuvring
and antibiotherapy. Conclusion: multidrug Acinetobacter baumannii is increasin-
gly isolated in our hospital. Rational use of antibiotics and rigorous application of
hygienic rules could contribute to limit dessimination of such strains.
Key words:Acinetobacter baumannii, multidrug, genotyping, infection,
antibiotic
Tirés à part : W. Mansour
abc
Ann Biol Clin 2007 ; 65 (6) : 593-9
doi: 10.1684/abc.2007.0166
Ann Biol Clin, vol. 65, n° 6, novembre-décembre 2007 593
Copyright © 2017 John Libbey Eurotext. Downloaded by a robot coming from 88.99.165.207 on 26/05/2017.

Acinetobacter baumannii est une espèce bactérienne fré-
quemment identifiée dans les infections nosocomiales
humaines. Au niveau du CHU Sahloul, Acinetobacter
baumannii est le bacille à Gram négatif non fermentant le
plus isolé avec un taux de 53,4 % suivi par Pseudomonas
aeruginosa. Ces bacilles non fermentants représentent
20 % de l’écologie générale de l’hôpital.
Il s’agit d’un coccobacille à Gram négatif, commensal de
la peau et notamment de ses régions humides et du tube
digestif. C’est un pathogène opportuniste qui peut être
responsable d’infections sévères malgré sa faible viru-
lence, en particulier chez les patients immunodéprimés.
L’incidence des infections à Acinetobacter baumannii a
considérablement augmenté durant les 30 dernières
années en particulier dans les services à haut risque (unité
des soins intensifs) [1, 2]. En 1995, les Acinetobacter sont
isolés dans 9 % des infections nosocomiales alors qu’ils
ne représentaient que 1 % de celles-ci en 1983 [3]. Cette
bactérie présente une grande persistance dans l’environne-
ment des patients, ce qui explique en très grande partie la
difficulté à enrayer rapidement les épidémies à Acineto-
bacter baumannii en l’absence d’un nettoyage complet et
soigneux. Durant les dernières années, la résistance d’Aci-
netobacter baumannii aux antibiotiques n’a cessé d’aug-
menter et des épidémies intra-hospitalières dues à des sou-
ches multirésistantes sont régulièrement rapportées [4, 5].
Notre étude a pour objectif d’étudier les différents para-
mètres impliqués dans l’acquisition d’infection nosoco-
miale à Acinetobacter baumannii résistants à l’imipénème
isolés au CHU Sahloul en Tunisie et d’étudier le degré de
clonalité de ces souches par une technique génotypique :
AP-PCR.
Matériels et méthodes
Il s’agit d’une étude rétrospective sur une durée de 2 ans
allant de juin 2002 à juillet 2004, réalisée au laboratoire
de microbiologie au CHU Sahloul, Sousse. Il s’agit d’un
hôpital universitaire de 548 lits à vocation essentiellement
chirurgicale.
Souches bactériennes
et sensibilité aux antibiotiques
L’étude a inclus 24 souches bactériennes d’Acinetobacter
baumannii résistantes à l’imipénème, isolées au CHU
Sahloul à partir de différents services d’hospitalisation
(tableau 1). L’identification de ces souches a été réalisée
par les techniques conventionnelles en utilisant les carac-
tères biochimiques à l’aide des galeries API20NE (bioMé-
rieux, France).
L’étude de la sensibilité aux antibiotiques a été réalisée
par la méthode de diffusion en milieu gélosé selon les
Tableau 1. Caractéristiques épidémiologiques des patients.
Désignation de l’isolat Date d’hospitalisation Date d’isolement Service d’hospitalisation Type de prélèvement
1 19/06/02 08/07/02 Réanimation Pus
2 21/07/02 05/08/02 Réanimation Urine
3 19/09/02 27/09/02 Réanimation Sang
4 23/09/02 08/10/02 Réanimation Drain
5 18/12/02 27/01/03 Réanimation Pus
6
a
03/01/03 01/02/03 Réanimation Pus
6
b
13/02/03 Réanimation Pus
7 07/10/03 28/02/03 Réanimation Pus
8 07/02/03 31/03/03 Chirurgie P. distal protégé
9 05/03/03 03/04/03 Réanimation Drain
10 08/04/03 19/04/03 Réanimation Sang
11 16/08/03 25/08/03 Neurochirurgie LCR
12 26/11/03 19/12/03 Réanimation Sang
13 04/12/03 15/12/03 Réanimation Urine
14 02/01/04 12/01/04 Brûlé Sang
15 18/12/03 13/01/04 Réanimation Liquide pleural
16 18/01/04 30/01/04 Pédiatrie Sonde trachéale
17
a
03/02/04 12/02/04 Brûlé Urine
17
b
14/02/04 Sang
17
c
18/02/04 Sonde trachéale
18
a
05/02/04 23/02/04 Réanimation Sang
18
b
02/03/04 Sang
19 13/05/04 02/07/04 Pédiatrie Brûlure
20 11/07/04 19/07/04 Réanimation Sang
article original
Ann Biol Clin, vol. 65, n° 6, novembre-décembre 2007594
Copyright © 2017 John Libbey Eurotext. Downloaded by a robot coming from 88.99.165.207 on 26/05/2017.

recommandations du « CA-SFM » [6]. Les b-lactamines
testées étaient les suivantes : ticarcilline, ticarcilline +
acide clavulanique, pipéracilline, pipéracilline + tazobac-
tam, ceftazidime, imipénème, cefpirome et aztréonam.
Étude des dossiers cliniques
Les dossiers cliniques des 20 patients ont été étudiés afin
d’élucider les différents paramètres favorisant l’infection
par Acinetobacter baumannii résistant à l’imipénème. Les
critères d’étude étaient : le sexe et l’âge des patients, le
motif d’hospitalisation, le traitement antibiotique et les
manœuvres invasives subies par les patients [7-9].
Caractérisation génotypique des souches étudiées
Les souches étudiées ont été typées par une technique
génotypique reposant sur l’amplification de l’ADN géno-
mique bactérien par une amorce arbitraire : séquence du
core du phage Lambda désignée par M13 et dont la
séquence est la suivante : 5’-GAG GGT GGC GGT
TCT-3’ [10]. Le mélange réactionnel et les conditions
d’amplification sont tels que décrits précédemment [10]. .
Résultats
Les souches bactériennes concernées par cette étude sont
des souches d’Acinetobacter baumannii résistantes à
l’imipénème. Cette résistance est un phénomène de plus
en plus rencontré au niveau de notre hôpital, le pourcen-
tage de résistance de ces souches est passé de 44 % en
2002 à 51,5 % en 2004 (figure 1). Ces bactéries sévissent
souvent en état endémique avec l’éclosion de quelques
bouffées épidémiques.
Analyse des données cliniques
Les bactéries étudiées ont été isolées de différents services
de l’hôpital et à partir de différents types de prélèvements
(tableau 1). Le service le plus évoqué est celui de la réani-
mation et le prélèvement le plus retrouvé est l’hémocul-
ture. Douze des patients étudiés sont décédés, ce qui nous
donne un pourcentage de mortalité de 60 %.
Sexe et âge des patients
Les patients étudiés sont dans plus que la moitié des cas
de sexe masculin (12/20). La moitié des patients étudiés
avait un âge > 60 ans (figure 2).
Motif d’hospitalisation
Dans 55 % des cas, le motif d’hospitalisation a été un
polytraumatisme suite à un accident (tableau 2).
Antibiothérapie
Tous les patients étudiés ont eu une antibioprophylaxie
pour les interventions chirurgicales qu’ils ont subies.
L’antibiotique utilisé étant l’amoxicilline-acide clavulani-
que. Pour l’antibiothérapie curative, tous les patients ont
reçu des antibiotiques dans le mois précédent l’infection
par Acinetobacter baumannii. Treize patients ont reçu au
moins une b-lactamine : l’imipénème ou la ticarcilline,
une céphalosporine de première génération : céfalotine ou
une céphalosporine de troisième génération : céfotaxime
ou ceftazidime. Chez 12 des patients étudiés, l’antibiothé-
rapie a inclus l’imipénème (tableau 2). Cependant, cer-
tains des germes responsables d’infections ont gardé une
0
20
40
60
80
100
Nombre de cas
2002 2003 2004 Années
Nombre total
Nombre de souches résistantes à l’imipénème
Figure 1. Distribution annuelle du nombre de souches d’Acineto-
bacter baumannii total et du nombre de souches résistantes à
l’imipénème.
0
2
4
6
8
Nombre de patients
0 à 20 21 à 40 41 à 60 > 60
Années
Figure 2. Nombre de patients étudiés répartis par tranche d’âge
(en années).
Acinetobacter baumannii résistant à l’imipénème
Ann Biol Clin, vol. 65, n° 6, novembre-décembre 2007 595
Copyright © 2017 John Libbey Eurotext. Downloaded by a robot coming from 88.99.165.207 on 26/05/2017.

sensibilité vis-à-vis d’un aminoside (gentamicine ou ami-
kacine), de la rifamycine et de la colistine. Ce dernier
faisant partie des molécules utilisées de manière très
timide au niveau de notre structure hospitalière en raison
de néphro-toxicité.
Manœuvres invasives
Tous les patients ont subi au moins une manœuvre inva-
sive durant leur hospitalisation et ceci avant l’infection à
Acinetobacter baumannii. Il s’agit d’une ventilation artifi-
cielle et d’intubation (25 % des cas), de cathétérisme
(24 %), de pose d’une sonde (15 %) ou de drainage (11 %
des cas). Les 20 patients concernés par cette étude ont subi
au moins une intervention chirurgicale.
Analyse des données bactériologiques
Outre la résistance à l’imipénème qui a été le critère de
sélection de nos souches, toutes les b-lactamines testées
sont sans effet sur les souches étudiées.
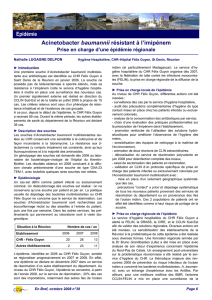
La caractérisation génotypique des souches étudiées a
démontré leur clonalité. Un seul profil a été retrouvé après
l’amplification aléatoire de l’ADN génomique bactérien
(figure 3).
Discussion
Acinetobacter baumannii est une espèce fréquemment
responsable d’infections nosocomiales au sein du CHU
Sahloul, en particulier dans les services à haut risque. Ces
infections posent un problème thérapeutique difficile à
gérer en raison de la multirésistance de cette espèce bacté-
rienne et le terrain sur lequel elles surviennent.
Le degré de recrudescence de ce type de bactérie en milieu
hospitalier est variable selon les services et les pays, en
fonction des habitudes de prescription d’antibiotiques et
des pratiques d’hygiène.
Les bactéries non fermentantes représentent 20 % de
l’écologie générale du CHU Sahloul. Acinetobacter
baumannii représente 53,4 % de ce type de bactéries suivi
par Pseudomonas aeruginosa (42,6 %). Cette distribution
est surtout reliée au type d’activité des services hospita-
liers ; elle est en fait plus élevée dans les unités des soins
intensifs et de chirurgie.
La résistance à l’imipénème chez Acinetobacter bauman-
nii est un phénomène de plus en plus rapporté au niveau
de notre hôpital, témoignant de la présence chez ces bacté-
ries d’un arsenal extrêmement vaste et divers pour contre-
Tableau 2. Caractéristiques cliniques des patients.
Désignation
de l’isolat
Sexe A
ˆge
(années)
Motif
d’hospitalisation
Traitement antibiotique Issue
Avant résultat Après résultat
1 F 68 Détresse respiratoire Imipénème Gentamicine Décédée
2 M 72 Polytraumatisme (accident) Gentamicine Décédé
3 M 20 Polytraumatisme (accident) Ceftazidime Imipénème Amikacine Décédé
4 M 28 Polytraumatisme (accident) Gentamicine Guéri
5 M 62 Polytraumatisme (accident) - - Guéri
6
a
M 60 Polytraumatisme (accident) Ceftazidime Imipénème Gentamicine Décédé
6
b
7 F 46 Polytraumatisme (accident) Ceftazidime Imipénème Gentamicine Guérie
8 M 76 Triple pontage Ticarcilline Imipénème Amikacine,
Gentamicine,
Rifamycine, Colistine
Décédé
9 F 80 Polytraumatisme (accident) Imipénème Amikacine Décédée
10 M 50 Polytraumatisme (accident) Imipénème Rifamycine Décédé
11 M 79 Hématome chronique Céfotaxime Gentamicine Guéri
12 M 23 Polytraumatisme (accident) - - Guéri
13 M 67 Polytraumatisme (accident) Imipénème Gentamicine Guéri
14 F 75 Brûlures étendues Ceftazidime Décédée
15 F 31 Sclérose en plaques Ofloxacine Rifamycine Guérie
16 F 02 Pneumonie Céfotaxime Imipénème Amikacine Guérie
17
a
M 30 Brûlures graves Imipénème Amikacine Décédé
17
b
17
c
18
a
F 27 Détresse respiratoire
(syndrome de Hodgkin)
Imipénème Amikacine Décédée
18
b
19 F 03 Brûlures étendues Ceftazidime - Décédée
20 M 63 Polytraumatisme (accident) Imipénème - Décédé
article original
Ann Biol Clin, vol. 65, n° 6, novembre-décembre 2007596
Copyright © 2017 John Libbey Eurotext. Downloaded by a robot coming from 88.99.165.207 on 26/05/2017.

carrer l’action antibiotique et d’un éventail très large de
combinaisons de résistance et d’opportunités de dissémi-
nation. Des études phénotypiques et moléculaires à la
recherche des mécanismes de résistance à l’imipénème
chez ces souches ont démontré la co-existence de méca-
nismes de résistance non enzymatiques (imperméabilité
membranaire) et de mécanismes enzymatiques (produc-
tion d’oxacillinases à activité carbapénémase) [données
personnelles]. C’est dans ce cadre que le choix des sou-
ches étudiées était limité à un profil de multirésistance
incluant essentiellement la résistance à l’imipénème. Tou-
tes les souches étudiées ont montré un seul profil génoty-
pique témoignant d’une dissémination clonale du même
germe au sein des différents services de l’hôpital et sur
plusieurs épisodes épidémiques.
Le sexe masculin a été noté dans 12/20 des cas au niveau
de notre étude ; ce résultat dépend des types d’infection et
des services d’hospitalisation, on retrouve au niveau de la
littérature des études démontrant la prédominance du sexe
féminin [7, 11]. Concernant l’âge, ce sont les sujets à âge
très avancé qui ont été le plus concerné. Ce résultat est en
accord avec la littérature [12]. Ceci peut être expliqué par
la nature de l’activité de notre hôpital qui est essentielle-
ment à vocation chirurgicale. De plus, les progrès médi-
caux ont permis les hospitalisations des âges très tardifs de
patients ayant des défaillances multiviscérales, ce qui
favorise l’immunodépression et l’hospitalisation de lon-
gue durée notamment en réanimation, et donc l’infection
nosocomiale [13].
Le motif d’hospitalisation représente un facteur de risque
non négligeable pour l’acquisition des infections à Acine-
tobacter. La majorité des patients concernés par cette
étude ont été admis au CHU Sahloul suite à un trauma-
tisme, le reste est admis pour causes diverses : brûlures,
détresse respiratoire, maladies graves. Braibar et al. ont
démontré [14] que la détresse respiratoire et le trauma-
tisme crânien étaient les principaux facteurs prédisposant
à la pneumonie due à Acinetobacter baumannii. Garcia
Garmandia et al. [7] ont montré que chez les brûlés, une
surface totale du corps brûlée supérieure à 50 % et
l’hydrothérapie sont les facteurs de risques majeurs
pour l’acquisition d’une bactériémie à Acinetobacter
baumannii.
Parallèlement à ces facteurs prédisposant les patients hos-
pitalisés à l’infection nosocomiale à Acinetobacter bau-
mannii, on note d’énormes difficultés thérapeutiques de ce
germe du fait qu’il est doué d’une grande capacité adapta-
tive lui permettant de développer très rapidement une
résistance aux antibiotiques.
Jusqu’aux années soixante-dix, les infections nosocomia-
les dues à Acinetobacter baumannii pouvaient être traitées
avec succès avec la gentamicine, la minocycline et l’acide
nalidixique ; entre les années 1971 et 1974, une augmen-
tation de la résistance a commencé à être notée et de
grandes proportions de souches sont devenues résistantes
à ces antibiotiques. L’imipénème est resté l’antibiotique
de choix dans le traitement des infections nosocomiales à
Acinetobacter baumannii jusqu’aux années quatre-vingt-
dix pendant lesquelles la résistance à l’imipénème a
émergé. De nombreuses épidémies dues à des souches
résistantes à l’imipénème ont été décrites dans plusieurs
pays sans répartition géographique particulière. Cepen-
dant, des différences au niveau de la sensibilité aux autres
antibiotiques sont notées, probablement à cause des fac-
teurs de l’environnement, d’une part, et des différences au
niveau des modalités d’usage des antibiotiques, d’autre
part [15-21].
Tous les patients étudiés ont eu une antibiothérapie pen-
dant le mois précédant l’infection, ce qui représente un
important facteur de risque pour le développement de
l’infection. L’utilisation des antibiotiques exerce une pres-
sion de sélection qui joue un rôle très important dans
l’émergence de souches multirésistantes d’Acinetobacter
baumannii [22]. Go et al. [23] ont montré que l’utilisation
de l’imipénème pour le traitement des infections à Kleb-
siella résistantes aux céphalosporines a permis à d’autres
1 2 3 4 5 6a 6b 7 8 M M
14
11 12 18a 18b 2016 17b 17c M915 1917a1310
Figure 3. Profil électrophorétique suite à l’AP-PCR des souches d’Acinetobacter baumannii isolées au CHU Sahloul en Tunisie.
Acinetobacter baumannii résistant à l’imipénème
Ann Biol Clin, vol. 65, n° 6, novembre-décembre 2007 597
Copyright © 2017 John Libbey Eurotext. Downloaded by a robot coming from 88.99.165.207 on 26/05/2017.
 6
6
 7
7
1
/
7
100%