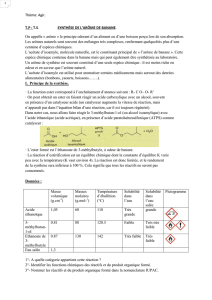
Document 1 : Données Couples acido

TP chimie : synthèse d’une molécule d’intérêt biologique (ester à odeur de banane)
1
!
Document!1!:!Données!
! !"#$%&'()*+,"-.)'+/#&'(0(!123(421(5(4!16-7(&8((0(!46!124(5(!46!12-(7!
! !
9'$:*&(*;+<+/#&(
=)''&(<"%)+>&(
<"%?*#%)+>&(0@A<"%-
B7!
=)''&(C"%#<+/#&(
0@A<D-B7!
E&<$?>)8#>&(
,F?.#%%+8+"G(
0H!7!
I"%#.+%+8?(,)G'(
%F&)#!
"#$%&!'()*+,-./&!
0121!
3214!
335!
6,7/87&!
9:;'()<78/(*+:3:,7!
5521!
5231=31:3!
3>5!
?@AB!C&/!B,7/87&!
D*/!
3521!
3211!
311!
!
D()*+,*(&!%&!9:
;'()<78/(<7&!
391!
52E1=31:3!
3F9!
G+B,7/87&!
"#$%&!B/7H/@$./&!
!
!
!
?@AB!B,7/87&!
! IJ*7#,,7!%J$B,*;<7&2!7J*#'(*(&!%J$B,*;<7&!&(!7J*#$%&!'()*+,-./&!B,+(!;$B#$87&B!
!
Document!2!:!Le!chauffage!à!reflux!
!
Si#au#cours#d’une#réaction#à#température#élevée#on#veut#éviter#la#perte#de#réactifs#ou#
de#produits#sous#forme#de#vapeurs,#on#réalise#un#chauffage#à#reflux.#La#transformation#
lente%à%température%ordinaire%est!accélérée'en'chauffant'le'milieu'réactionnel.!
1:!!"#$%%#&'()*'+,-./$'(01.(2#,.3-'1(4-./$'16!
2:!Élévateur!
9:!K*77,+!
4:!Réfrigérant* à* boules* (elles* augmentent* la* surface* de* contact* avec* le* fluide*
réfrigérant)!
4:!6(*($H!
6:!Arrivée'd’eau!
E:!6,@($&!%J&*/!
8:!Pierre%ponce%(homogénéisation%de%l’ébullition)!
9:!Mélange(réactionnel!
!
Principe(:(les(vapeurs( qui(se( forment(sont(condensées(dans( le(réfrigérant,(en(liquides(et( retournent(dans( le(
milieu&réactionnel.&Rem&:&on&peut&aussi&utiliser&un&!"#!$%"!&'()*)&$!)+,')(,-./0!
!
Document!3!:!L’ampoule!à!décanter!
!
1:!Ampoule(à(décanter!
>:!L)*B&!*./&/B&!
9:!L)*B&!,@M*+$./&!
F:!D@7&+;&<&@!
I*!%$BC,B$($,+!%&B!C)*B&B!&B(!#,@@&#(&!B$!7*!%&+B$('!%&!7*!C)*B&!,@M*+$./&!&B(!$+H'@$&/@&!N!3=!6$+,+!
#J&B(!7*!C)*B&!*./&/B&!./$!B/@+*M&=!!
!
Document!4!:!La!filtration!
Elle$permet$la$séparation$d’un$solide$et$d’un$liquide.$On$peut$réaliser$
/+&!H$7(@*($,+!simple'ou'une'filtration'sous'vide'(sur'Büchner).!
!
J+%8>)8+"G( '+<$%&(K!1:!Bécher,2:!Filtrat,( 3:!Solution( à( filtrer,( 4:!
"M$(*(&/@!&+!O&@@&2!4:!D+(,++,$@2!0:!P$7(@&!C*C$&@2!E:!6(*($H!
!
J+%8>)8+"G( '#>( LM*;G&>(Q!1:!Fiole& à& vide,& 2:!Filtrat,( 3:!Aspiration*
!"#$%&'()('*+,-(.:!Filtre'papier,'5:!Büchner,)6:!Solution(à(filtrer!
!
!!!
"#$%&!'($)*+!,-.*!Ȃ!$*"*/(&+0! ! 12345!678!!
!
!""#$#% &%'(")*+#,%-%.(""*/)0#%
!
1 ² Le chauffage à reflux.
!!9:4;!4<=!<>?!@?=ABC=!D!
!!"A34?E4B!;4!<FGAH2I!
!!ǯB!ǯǤ!
!!9:4;!4<=!;4!BJ;4!E4<!3B2@?<!E4!K@4BB4!K>?F4!!!D!
!
!
!
!
2 ² La filtration.
!!L!M:>@!<4B=N4;;4!D!
!!"A34?E4B!;4<!<FGAH2<I!
!!ǯ±²ǫ!
! ! 9:4;;4! >KAB2=@>?! 4<=N@;! K2BO>@<! ?AF4<<2@B4! E4! BA2;@<4B! 2P2?=! ;2!
O@;=B2=@>?!D!!
!
3 ² /¶H[WUDFWLRQ
!!(?E@M:4B!ǯǯ
±ǯǫ!
!!9:4!<4!K2<<4N=N@;!<@!;2!E4?<@=A!E:!<>;P2?=!4<=!<:KAB@4:B4!Q!F4;;4!E4!ǯǫ!
!
!
!
4 ² La distillation.
! ! "A34?E4B! 4=! F>HH4?=4B! ;4<! E4:R!
H>?=234<I!
!!9:4;!4<=!;4!KB@?F@K4!E4!;2!E@<=@;;2=@>?!D!!
!!ǯNǯǫ!
!
!
5 ² La chromatographie.
!!"A34?E4B!;4<!<FGAH2<I!
!!(?E@M:4B!;4!KB@?F@K4!E4!;2!FGB>H2=>3B2KG@4I!
!!9:4;!4<=!<>?!@?=ABC=!D!!
!!1BAF@<4B!ǯǤ!
!!
!
"
#
$
%
&
'
(
)
!
"
#
$
%
&
'
!
"
#
$
%
&
!
"
#
$
!
"
#
$
%
&
(
!
"
'
'
&
%
(
$
#
)
#
"
$
!
!
"
#
$
!!!
"#$%&!'($)*+!,-.*!Ȃ!$*"*/(&+0! ! 12345!678!!
!
!""#$#% &%'(")*+#,%-%.(""*/)0#%
!
1 ² Le chauffage à reflux.
!!9:4;!4<=!<>?!@?=ABC=!D!
!!"A34?E4B!;4!<FGAH2I!
!!ǯB!ǯǤ!
!!9:4;!4<=!;4!BJ;4!E4<!3B2@?<!E4!K@4BB4!K>?F4!!!D!
!
!
!
!
2 ² La filtration.
!!L!M:>@!<4B=N4;;4!D!
!!"A34?E4B!;4<!<FGAH2<I!
!!ǯ±²ǫ!
! ! 9:4;;4! >KAB2=@>?! 4<=N@;! K2BO>@<! ?AF4<<2@B4! E4! BA2;@<4B! 2P2?=! ;2!
O@;=B2=@>?!D!!
!
3 ² /¶H[WUDFWLRQ
!!(?E@M:4B!ǯǯ
±ǯǫ!
!!9:4!<4!K2<<4N=N@;!<@!;2!E4?<@=A!E:!<>;P2?=!4<=!<:KAB@4:B4!Q!F4;;4!E4!ǯǫ!
!
!
!
4 ² La distillation.
! ! "A34?E4B! 4=! F>HH4?=4B! ;4<! E4:R!
H>?=234<I!
!!9:4;!4<=!;4!KB@?F@K4!E4!;2!E@<=@;;2=@>?!D!!
!!ǯNǯǫ!
!
!
5 ² La chromatographie.
!!"A34?E4B!;4<!<FGAH2<I!
!!(?E@M:4B!;4!KB@?F@K4!E4!;2!FGB>H2=>3B2KG@4I!
!!9:4;!4<=!<>?!@?=ABC=!D!!
!!1BAF@<4B!ǯǤ!
!!
!
"
#
$
%
&
'
(
)
!
"
#
$
%
&
'
!
"
#
$
%
&
!
"
#
$
!
"
#
$
%
&
(
!
"
'
'
&
%
(
$
#
)
#
"
$
!
!
"
#
$
!!!
"#$%&!'($)*+!,-.*!Ȃ!$*"*/(&+0! ! 12345!678!!
!
!""#$#% &%'(")*+#,%-%.(""*/)0#%
!
1 ² Le chauffage à reflux.
!!9:4;!4<=!<>?!@?=ABC=!D!
!!"A34?E4B!;4!<FGAH2I!
!!ǯB!ǯǤ!
!!9:4;!4<=!;4!BJ;4!E4<!3B2@?<!E4!K@4BB4!K>?F4!!!D!
!
!
!
!
2 ² La filtration.
!!L!M:>@!<4B=N4;;4!D!
!!"A34?E4B!;4<!<FGAH2<I!
!!ǯ±²ǫ!
! ! 9:4;;4! >KAB2=@>?! 4<=N@;! K2BO>@<! ?AF4<<2@B4! E4! BA2;@<4B! 2P2?=! ;2!
O@;=B2=@>?!D!!
!
3 ² /¶H[WUDFWLRQ
!!(?E@M:4B!ǯǯ
±ǯǫ!
!!9:4!<4!K2<<4N=N@;!<@!;2!E4?<@=A!E:!<>;P2?=!4<=!<:KAB@4:B4!Q!F4;;4!E4!ǯǫ!
!
!
!
4 ² La distillation.
! ! "A34?E4B! 4=! F>HH4?=4B! ;4<! E4:R!
H>?=234<I!
!!9:4;!4<=!;4!KB@?F@K4!E4!;2!E@<=@;;2=@>?!D!!
!!ǯNǯǫ!
!
!
5 ² La chromatographie.
!!"A34?E4B!;4<!<FGAH2<I!
!!(?E@M:4B!;4!KB@?F@K4!E4!;2!FGB>H2=>3B2KG@4I!
!!9:4;!4<=!<>?!@?=ABC=!D!!
!!1BAF@<4B!ǯǤ!
!!
!
"
#
$
%
&
'
(
)
!
"
#
$
%
&
'
!
"
#
$
%
&
!
"
#
$
!
"
#
$
%
&
(
!
"
'
'
&
%
(
$
#
)
#
"
$
!
!
"
#
$

TP chimie : synthèse d’une molécule d’intérêt biologique (ester à odeur de banane)
2
I? SYNTHESE!DE!L’ETHANOATE!DE!3?METHYLBUTYLE!
:!R*+B!/+!8*77,+2!$+(@,%/$@&!%*+B!7J,@%@&2!'"#'(%)(;"88&(()'$+>)G8&!&(!*O&#!
C@'#*/($,+B!421!;I!%J*7#,,7!$B,*;<7$./&!S!9:;'()<78/(*+:3:,7!T!2!E21!;I!
%J*#$%&!'()*+,-./&!&(!>!M,/((&B!%J*#$%&!B/7H/@$./&!#,+#&+(@'!=!!S!N88&G8+"G!2!#&(!
*#$%&!&B(!(@AB!#,@@,B$H!T!
:!"U,/(&@!4!!M@*$+B!%&!C$&@@&!C,+#&=!!
:!"%*C(&@!7&!@'H@$M'@*+(!N!8,/7&B!&(!#)*/HH&@!N!'8/77$($,+!%,/#&!C&+%*+(!
&+O$@,+!>1!;$+/(&B!B/@!()&@;,B(*(!F:4=!
V'M7&@!7&!#)*/HH*M&!%&!B,@(&!./&!7*!#,+%&+B*($,+!%&B!O*C&/@B!B&!H*BB&!%*+B!7*!
C@&;$A@&!,/!7*!%&/W$A;&!8,/7&!%/!@'H@$M'@*+(!!!S!X,$@!Y,+(*M&!%&!#)*/HH*M&!N!
@&H7/W!!#$:%&BB,/B!T!
:!L@'C*@&@!/+!#@$B(*77$B,$@!#,+(&+*+(!%&!7J&*/!M7*#'&!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
NG)%O'&(,#($>"8"*"%&(,&(
'OG8;:'&(
!
1"Quel'est'le'rôle'de'l’acide'
sulfurique'?'
"catalyseur'
2"'Quel'est'le'rôle'de'la'pierre'
ponce'?'
"homogénéiser'le'mélange'
3"'Pourquoi'chauffe"t"on'le'
mélange'réactionnel'?'
"facteur'cinétique'
4"'Quel'est'l’intérêt'd’un'chauffage'
«'à'reflux'»'?'
"garder'les'réactifs'dans'le'milieu'
réactionnel'('ne'pas'les'perdre'par'
évaporation)'
5"'Vérifier'qu’un'seul'des'réactifs'
est'limitant.'Lequel'?''
"l’alcool'
'
6"'Légender'le'schéma'de'
chauffage'à'reflux'
"'ci"contre'
7"'Ecrire'l’équation"bilan'de'la'
réaction''
en'formule'semi"développée.'
Nommer'les'réactifs'et'les'produits'
formées.'Entourer'et'nommer'les'
groupes'fonctionnels'
"'alcool,'carboxyle!
8"'Calculer'la'masse'd’ester'
espérée''si'la'réaction'était'totale'
m_ester'='6,0'g!
II?EXTRACTION!LIQUIDE?LIQUIDE!DE!L’ESTER!
!I*O*M&!N!7J&*/!Z!"@@[(&@!7&!#)*/HH*M&2!%&B#&+%@&!7&!8*77,+!&(!7*$BB&@!
@&H@,$%$@!7&!8*77,+!N!7J*$@!=!L7*#&@!7&!8*77,+!%*+B!7J&*/!H@,$%&!=!"U,/(&@!
F1!;I!%J&*/!M7*#'&=!?@*+BO*B&@!%*+B!/+&!*;C,/7&!N!%'#*+(&@!S!
B*/H!7*!C$&@@&!C,+#&!T!#,+(&+*+(!&+O$@,+!F1!;I!%J&*/!M7*#'&!!
V$+#&@!7&!8*77,+!*O&#!/+!C&/!%J&*/!&(!@*U,/(&@!*/!#,+(&+/!%&!
7J*;C,/7&=!R'#*+(&@=!!
!
D7$;$+&@!7*!C)*B&!*./&/B&!&(!#,+B&@O&@!7*!C)*B&!,@M*+$./&!%*+B!
7J*;C,/7&=!
Y&B/@&@!7&!C\!%&!7*!C)*B&!*./&/B&!*O&#!%/!C*C$&@!C\=!!
I*O*M&!%&!7*!C)*B&!,@M*+$./&!*O&#!/+&!B,7/($,+!*./&/B&!8*B$./&!!S!
"((&+($,+!T!
R*+B!/+!O&@@&!N!C$&%2!O&@B&@!7*!C)*B&!,@M*+$./&=!"U,/(&@!&+O$@,+!91!;I!
%J/+&!B,7/($,+!%J)<%@,M'+,#*@8,+*(&!%&!B,%$/;!S!N!31!]!T!=!"M$(&@!
N!7J*$%&!%&!7*!8*M/&((&!%&!O&@@&=!
^8B&@O&@!7&!%'M*M&;&+(!M*_&/W=!"M$(&@=!!
NG)%O'&(,#($>"8"*"%&(
,F+'"%&<&G8(
(
`:!P*$@&!/+!B#)';*!%&!7J*;C,/7&!
N!%'#*+(&@!a!I'M&+%&@!B&B!%&/W!
C)*B&B!L@'#$B&@!7&/@B!
#,;C,B$($,+B!S!B,7O*+(B!&(!B,7/('B!
T!&(!7&/@B!#,/7&/@B!
: %&/W!C)*B&B!B,+(!
C@'B&+(&B!Q!&B(&@!&(!&*/!
: 7J&B(&@!B/@+*M&2!#*@!$7!*!
/+&!;*BB&!O,7/;$./&!
$+H'@$&/@&!N!#&77&!%&!7J&*/!
31:!G+(&@C@'(&@!7*!O*7&/@!%&!C\!
(@,/O'&=!
C\!8*B2!#*@!7J&W#AB!%J*#$%&!
'()*+,-./&!B&!(@,/O&!%*+B!7*!
C)*B&!*./&/B&=!
33:!L,/@./,$!+&!@'*7$B&:(:,+!C*B!
%$@&#(&;&+(!/+!7*O*M&!8*B$./&!b!
:!@'C,+B&!33!
3>:!D#@$@&!7&B!'./*($,+B!
!
"
#
$
%
&
1-sortie d’eau,
2- réfrigérant à boules,
3- arrivée d’eau,
4- ballon rond,
5- chauffe ballon,
6- élévateur

TP chimie : synthèse d’une molécule d’intérêt biologique (ester à odeur de banane)
3
!
I,@B./J$7!+J<!*!C7/B!%&!%'M*M&;&+(!M*_&/W!O$B$87&2!(@*+BO*B&@!%*+B!
7J*;C,/7&!N!%'#*+(&@=!"M$(&@!7J&+B&;87&=!R'M*_&@!B,/O&+(!ccc!
"((&+($,+!ccc!
I*$BB&@!@&C,B&@=!D7$;$+&@!7*!C)*B&!*./&/B&!&(!H*$@&!/+!%&/W$A;&!7*O*M&!&+!
C@&+*+(!7&B!;[;&B!C@'#*/($,+B!!
D7$;$+&@!7*!C)*B&!*./&/B&!&(!O'@$H$&@!./&!B,+!C\!+J&B(!C7/B!*#$%&=S!C*C$&@!
C\!T=!6$+,+!H*$@&!/+!*/(@&!7*O*M&='
#)$;$./&B!%&B!@'*#($,+B!*#$%,:
8*B$./&B!;$B&B!&+!U&/=!
:!@'C,+B&!3>!
39:!d/&7!&B(!7&!M*_!H,@;'!b!
:!%$,W<%&!%&!#*@8,+&(
III"'SECHAGE'DE'LA'PHASE'ORGANIQUE'
V&#/&$77$@!7*!C)*B&!,@M*+$./&!%*+B!/+!&@7&+;&<&@!&(!!e!B&+($@!S!&+!H*$B*+(!
/+!#,/@*+(!%J*$@!*O&#!7*!;*$+!T!
f!*U,/(&@!3!M!%&!B/7H*(&!%&!;*M+'B$/;!*+)<%@&=!"M$(&@!%,/#&;&+(!>!N!9!
;$+/(&B=!I*$BB&@!@&C,B&@!=!6$!7*!C)*B&!,@M*+$./&!&B(!!&+#,@&!
(@,/87&2!$7!<!*!%&B!(@*#&B!%J&*/!B$+,+!&77&!%,$(
TP chimie : synthèse d’une molécule d’intérêt biologique (ester à odeur de banane)
4
E=!
!
!
5=!!
+j&B(&@g+j*7#,,7!B$!7*!@'*#($,+!'(*$(!(,(*7&2!#*@!7J*7#,,7!&B(!@'*#($H!7$;$(*+(!&(!7&B!#,&HH$#$&+(B!B(,&#)$,;'(@$./&B!
B,+(!(,/B!'M*/W!N!3=!
;j&B(&@!g!+j&B(&@!W!Yj&B(&@!g!F20!W!31:>!W!39121!g!021!M!
!
!
33=!!
^+!'7$;$+&!7*!C)*B&!*./&/B&!./$!#,+($&+(!%&!7J*#$%&!'()*+,-./&=!Y*$B!%*+B!7*!C)*B&!,@M*+$./&!,+!*!&+#,@&!%&B!
(@*#&B!%J*#$%&!'()*+,-./&=!^+!H*$(!%,+#!/+!7*O*M&!*O&#!/+&!B,7/($,+!*./&/B&!8*B$./&!S!)<%@,M'+,#*@8,+*(&!%&!
B,%$/;T!C,/@!+&/(@*7$B&!7&!@&B(&!%J*#$%&=!
IJ$,+!'()*+,*(&!*$+B$!,8(&+/!&B(!B,7/87&!%*+B!7J&*/!&(!BJ'7$;$+&!*O&#!7*!C)*B&!*./&/B&=!
P*$@&!/+!7*O*M&!*O&#!7*!B,7/($,+!8*B$./&!*O*+(!%J'7$;$+&@!7*!C)*B&!*./&/B&!%&;*+%&@*$(!/+&!./*+($('!(@,C!
$;C,@(*+(&!%J)<%@,M'+,#*@8,+*(&2!*##,;C*M+'&!C*@!/+&!'7'O*($,+!%&!(&;C'@*(/@&!+,+:!+'M7$M&*87&!S!7*!
@'*#($,+!*#$%&:8*B&!&B(!&W,()&@;$./&T=!!
!
3>=!
!
1
/
4
100%