modèle flo

Activité expérimentale 12 : Les modèles moléculaires
Attitudes Travailler en équipe (37)
Rechercher : -Observer,extraire des informations d'un fait observé (3)
Principe : À l'aide des modèles moléculaires, nous essaierons de comprendre pourquoi un atome fait toujours
qu'un seul nombre de liaison. Nous travaillerons aussi l'isomérie.
1. Les modèles moléculaires
Une molécule est un édifice chimique neutre formé par l’association d’un nombre précis d’atomes grâce à des liaisons chimiques.
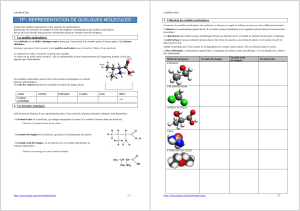
La molécule de valine ci-dessous est prise pour exemple.
La valine est un acide aminé essentiel : elle est indispensable au bon fonctionnement de l'organisme humain et doit être apportée par
l'alimentation.
Les modèles moléculaires peuvent être réels (boules en plastiques) ou virtuels (dessins informatiques).
Il existe deux types de modèles :
–Le modèle moléculaire compact ;
–Le modèle moléculaire éclaté.
Donner un avantage de chaque modèle. Un code des couleurs permet de reconnaître la nature de chaque atome
Atome Carbone Hydrogène Oxygène Azote chlore
Couleur symbolique
2. Les formules chimiques
Pour une représentation plane d’une molécule, plusieurs formules chimiques sont disponibles :
- la formule brute de la molécule, qui indique uniquement la nature et le nombre d’atomes dans une molécule ;
Chercher la formule brute de la valine
:
- la formule développée de la molécule, qui précise l'enchaînement des atomes et
le nombre de liaisons;
- la formule semi-développée , où les liaisons avec
les atomes d'hydrogène ne sont pas représentées ;
Donner un avantage de cette dernière formule
3. Utilisation des modèles moléculaires
3.1. Réaliser les modèles moléculaires de quelques molécules simples (voir le tableau 2 après le tableau 1) :
Compléter les tableaux suivants, en dessinant les modèles moléculaires de ces molécules.
3.2. D’autres molécules :
-L'éthanol est communément appelé alcool. Il est utilisé comme désinfectant et est également présent dans les boissons dites
alcoolisées.
-Le chloroforme était utilisé comme anesthésique de base au XIXème siècle. Il rendait les patients inconscients et détendus.
-L'acide lactique n'est pas seulement présent dans le lait. Dans les muscles, sous forme de lactate, il est ensuite recyclé en
glucose par le foie.
-L'urée est produite par le foie à partir de la dégradation de certains acides aminés. Elle est éliminée dans les urines.
-L'éther diéthylique, communément appelé éther, a longtemps été utilisé comme anesthésique. C'est un liquide très volatil et
très inflammable.


4. Synthèse
A partir du travail fait précédemment, compléter le tableau :
Atome Carbone Hydrogène Oxygène Azote Chlore
N° de colonne dans la classification
Nombre de liaisons que fait toujours
l'atome
Nombre de cases qui sépare l'élément
du gaz rare le plus proche dans le TPE.
Comment peut-on expliquer cette observation ?
En déduire le nombre de liaisons des autres atomes suivants :
Atome Fluor Soufre Silicum Brome Arsenic
N° de colonne dans la classification
Nombre de liaisons que fait toujours
l'atome
Nombre de cases qui sépare l'élément
du gaz rare le plus proche dans le TPE.
5. Isomérie
Remplir la dernière ligne du tableau précédent avec l’isomère de l’éthanol trouvé à l'aide des modèles moléculaires..
Pour les plus rapides :
Trouver le plus d'isomères possibles du C3H9N et les crire sous formes semi-développées en dessous :
1
/
3
100%